Гемобартонеллез у кошек и собак (распространение, эпизоотология, этиология, патогенез, диагностика и лечение). Биологические свойства Гемотропных Микоплазм у кошек (Mycoplasma Haemofelis, Mycoplasma haemominutum, Mycoplasma turicensis). Меры борьбы и профилактики при гемобартонеллезе у кошек

Этиология гемобартонеллеза у кошек и собак
Гемотропные микоплазмы (возбудители гемобартонеллеза) – бактериальные организмы без клеточной стенки, которые прикрепляются и растут на поверхности эритроцитов. Они Грамотрицательные некислотоустойчивые, и, несмотря на множественные попытки, культивирование их на искусственных средах оказалось безуспешным. Эти эпицеллюлярные организмы были классифицированы как риккетсии рода Haemobartonella и Eperythrozoon многие годы, однако, результаты последовательности 16S рибосомной РНК и Рибонуклеаз P РНК генов показывают, что они являются микоплазмами. Следовательно, роды Haemobartonella и Eperythrozoon были расформированы и эти микроорганизмы перешли в род Mycoplasma. Это вызвало споры. Из-за специфических биологических свойств и данных о последовательности, некоторые считают, что гемотропные микоплазмы должны быть выделены в отдельный род от микоплазм. Тем не менее, описанные названия видов часто имеют префикс «гемо-«, чтобы отличать этих уникальных микоплазм, которые прикрепляются к эритроцитам, в то время как новые, не полностью описанные таксоны имеют название Candidatus. Было предложено название Гемоплазмы для общего описания гемотропных микоплазм. Они содержат РНК и ДНК и размножаются путем бинарного деления. Они могут быть палочкообразными, сферическими или кольцеобразными, одиночными и в цепях на красных кровяных тельцах.
Гемотропные микоплазмы у кошек
Три гемоплазмы известно у кошек (возбудители гемобартонеллеза):
- M. Haemofelis
- Candidatus Mycoplasma haemominutum
- Candidatus Mycoplasma turicensis
Соответствие 16S рРНК и RNase (рибонуклеаза) P РНК последовательностей генов между ними составляет около 83%. Один из них раньше назывался Haemobartonella felis large вариант, и сейчас называется Mycoplasma Haemofelis, другой – H. Felis small – теперь классифицирован как Candidatus M. Haemominutum. Организмы, ранее называвшиеся Florida, Ohio, Oklahoma, Illinois сейчас классифицированы, как изоляты M. Haemofelis, а California, Birmingham – изоляты Candidatus M. Haemominutum согласно схожести последовательностей 16S рРНК гена. Последовательность 16S рРНК гена австралийского штамма M. Haemofelis идентична изолятам Ohio и Florida. Candidatus M. Turicensis – третий вид, был описан у швейцарских кошек. Схожесть последовательности 16S рРНК гена этого вида с M. Haemofelis и Candidatus M. Haemominutum составляет 88 и 83% соответственно.
При полихромном окрашивании крови гемотропные микоплазмы выглядят как маленькие темно-синие палочки, кокки или кольца немного большего размера, которые обычно прикреплены к эритроцитам. Размер генома M. haemofelis составляет примерно 1200 кб, что было определено с помощью строительства оптической модели их полного генома. В толстых мазках почти все организмы выглядят кокками. Кольцевые или палочкообразные формы более отчетливо видны в тонких мазках (Рис. 1). Candidatus M. Haemominutum редко видны в мазках инфицированных кошек. Когда видны, они представлены маленькими палочками или кокковидными организмами и нечасто кольцами, небольшое их количество приходится на каждый эритроцит, они располагаются менее плотно и меньше в половину, чем Mycoplasma haemofelis (примерно 0,3 μm) (Рис. 2). Однако, в Великобритании был обнаружен изолят Candidatus M.
Haemominutum около 0,6 μm в диаметре. Морфологически различия не столь значимы, поэтому для дифференцирования изолятов необходим генетический анализ. Candidatus M. Turicensis не был обнаружен при световой или электронной микроскопии зараженных кошек. Размер генома Candidatus M. Turicensis и Candidatus M. Haemominutum не был описан.
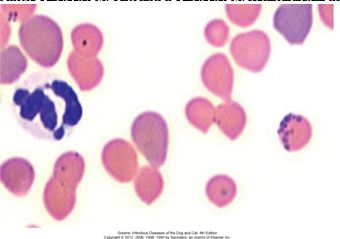
Рис. 1. M. haemofelis в мазке крови инфицированной гемобартонеллезом кошки; кольцевидные, палочкообразные и коккообразные формы с регенераторной анемией.
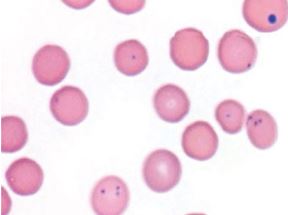
Рис. 2. Candidatus M. Haemominutum в мазке крови инфицированной гемобартонеллезом кошки; коккообразные формы без признаков регенерации и умеренной анемией.
Эпицеллюлярное (поверх клеток) расположение Mycoplasma haemofelis на эритроцитах становится очевидным при электронной микроскопии (Рис. 3). Микроорганизмы частично углублены в ямочки на поверхности эритроцитов. Наблюдаются дисковидные, конические, кокковые, палочковидные, тороидальной формы. Пораженные эритроциты могут терять привычную двояковогнутую форму и становится сфероцитами или стоматосфероцитами. Трансмиссивная электронная микроскопия (Рис. 4) также подтверждает эпицеллюлярное расположение. Зона в 15-25 нм разделяет микроорганизм от мембраны эритроцита, мягкие фибриллы идут от микоплазмы к эритроциту в местах плотного контакта. Отмечено образование пятен на мембране эритроцита, в то время как полной эрозии не наблюдается. Одиночная мембрана окружает организм. Цитоплазма состоит из гранул разного размера и плотности, цитоплазматические органеллы не обнаруживаются. У некоторых присутствуют вакуоли. Ультраструктура Candidatus M. Haemominutum схожа с M. haemofelis и другими Молликутами (класс бактерий). Они более мелкие, имеют плазматическую мембрану без клеточной стенки или внутренних мембранных структур.
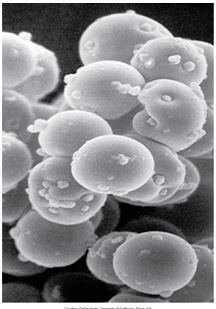 Рис. 3. Фото электронной микроскопии эритроцитов кошки с гемобартонеллезом, инфицированной Mycoplasma haemofelis (х5000).
Рис. 3. Фото электронной микроскопии эритроцитов кошки с гемобартонеллезом, инфицированной Mycoplasma haemofelis (х5000).
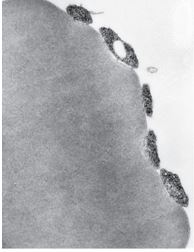
Рис. 4. Трансмиссивная электронная микроскопия пяти микроорганизмов Mycoplasma haemofelis в прерывистом контакте с плазмалеммой эритроцита у больной гемобартонеллезом кошки
Гемотропные микоплазмы собак
Mycoplasma haemocanis (ранее Haemobartonella canis) считается возбудителем микоплазмоза у собак, однако, последовательность 16S рРНК гена M. haemocanis оказалась практически идентична M. haemofelis (99% гомологичности), из чего следует, что данные агенты могут быть разными разновидностями одного и того же микроорганизма. Другие исследования, оценивающие последовательности генов рибонуклеазы Р (RNase P), показали меньшую гомологичность между ними (95%), следовательно эти микроорганизмы могут быть разными. В морфологическом плане M. haemocanis отличается от M. haemofelis тем, что чаще формирует цепи, идущие по поверхности эритроцитов (Рис. 5). Однако, отдельные микроорганизмы могут выглядеть как маленькие кокки, палочки или кольца.
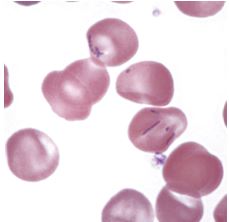
Рис. 5. Несколько эритроцитов с паразитирующими Mycoplasma haemocanis.
Результаты электронной микроскопии показывают, что M. haemocanis по своей ультраструктуре идентична M. haemofelis. Они также углубляются в поверхность эритроцитов, как было описано для M. haemofelis, цепи микроорганизмов часто образуют «канавки» или глубокие складки, заметно искажая форму эритроцитов.
Новая маленькая гемоплазма Candidatus Mycoplasma haematoparvum, которая генетически более близка к Candidatus M. Haemominutum, чем к M. haemofelis, была изолирована из крови сленэктомированной собаки с гематопоэтической неоплазией. В ПЦР исследовании во Франции эти микроорганизмы оказались более распространенными, чем M. haemocanis. В исследовании таким же методом в Швейцарии распространенность собачьих гемоплазм оказалась ниже. Исследование с обратной ПЦР в Судане показало высокую распространенность инфекций гемоплазмами.
Эпидемиология и патогенез гемобартонеллеза животных
Распространенность гемобартонеллезов
Сравнение исследований по распространенности гемоплазм проблематично, потому как популяции тестируемых кошек крайне различаются. Иногда исследуются кошки с анемией, в других исследованиях учитывают популяцию больных, вялых кошек, а третьих – всех кошек, независимо от статуса их здоровья. Также географический и климатический фактор могут сильно влиять на распространенность.
Исследования с использованием ПЦР в США и Испании показывают, что около 30% кошек с анемией имеют положительные результаты на гемотропных микоплазм (гемобартонеллез), у большинства обнаруживают только Mycoplasma haemofelis или в комбинации с Candidatus M. Haemominutum. В дополнение к этому, около 14% здоровых кошек контроля в США имеют положительные результаты ПЦР. Из них 19 были инфицированы только Candidatus M. Haemominutum и одна – обоими вариантами. Эти результаты надо интерпретировать с осторожностью, потому как только один вариант был обнаружен ПЦР у некоторых кошек, инфицированных экспериментально обоими вариантами гемоплазм. В другом исследовании в Испании было обнаружено 3,7% кошек положительных на M. haemofelis и 9,9% на Candidatus M. Haemominutum, и небольшое количество кошек имели оба варианта. Была обнаружена связь между инфекцией гемоплазмами и доступом из дома, инфекцией ВИК и мужским полом. В Канаде субклиническая форма инфекции была обнаружена у 12% кошек в приютах и у 4% кошек владельцев, однако не было обнаружено факторов риска, коррелирующих с инфекцией. В Японии при исследовании домашних кошек, у которых предполагали гемобартонеллез, 67% имели положительные результаты ПЦР на M. haemofelis, 22% - на M. Haemominutum, 11% имели коинфекцию. В Австралии распространенность среди кошек с афаниптерозом (блохи) распространенность M. haemofelis составила 0,9%, а M. Haemominutum – 15,3%.
У анемичных и неанемичных кошек, исследованных ПЦР в ветеринарном госпитале на западном побережье США, распространенность гемоплазменных инфекцией составила: 16% Candidatus M. Haemominutum, но только 0,4% имели оба варианта Candidatus M. Haemominutum и M. haemofelis. Вероятность наличия четвертого типа гемоплазм, похожего на M. haematoparvum, была обнаружена у 0,7% кошек. В исследовании в Великобритании мене 2% больных кошек (с анемией и без) и менее 2% здоровых кошек были инфицированы M. haemofelis. Распространенность Candidatus M. Haemominutum составила около 20% больных кошек (с анемией и без), при этом 8% здоровых кошек тоже имели положительные результаты. В исследовании диких кошек Северной Флориды 8% имели положительные результаты на M. haemofelis, 12% - Candidatus Mycoplasma Haemominutum. Как и в других исследованиях, самца были инфицированы чаще самок, и была отмечена положительная корреляция с ВИК и ВЛК инфекцией. Распространенность инфекции Candidatus M. Turicensis сравнивали в Швейцарии, Великобритании, США, Австралии и Южной Африке, распространенность среди больных и здоровых кошек составила 1, 2, 3, 10 и 26% соответственно. В Австралии у кошек с афаниптерозом она составила 0,9%. В Испании распространенность среди кошек была 7,9%.
M. haemocanis была отмечена у собак Северной Америки и Европы. На юге Франции распространенность (методом ПЦР) Candidatus M. haematoparvum составила 9,6%, а M. haemocanis – 3,3%. В Швейцарии только 1,2% собак имели положительные результаты ПЦР на собачьи гемоплазмы. Распространенность в Европе выше в странах средиземноморья. В исследованиях с обратной ПЦР на собаках со свободным выгулом в Судане была обнаружена гораздо большая распространенность. Считается, что наличие или отсутствие переносчиков может объяснять эти различия.
Гемобартонеллез у кошек
Судя по морфологическим особенностям, клиническим признакам и лабораторным данным, почти все публикации относительно кошачьего гемобартонеллеза до 1998 года касаются M. haemofelis. Подвиды Флорида и Огайо, используемые в экспериментах, согласно ПЦР и последовательности 16S рРНК генов идентичны M. haemofelis. M. haemofelis часто вызывает анемию и клинические признаки заболевания, в то время как Candidatus M. Haemominutum приводит к бессимптомной инфекции и минимальному снижению гематокрита, если не связана с ВИК, ВЛК или другой сопутствующей болезнью. Дальнейшее описание патогенеза заболевания касается инфекции M. haemofelis.
Экспериментально, Mycoplasma haemofelis передается внутриперитонеальной, внутривенной инъекцией или пероральным введением зараженной крови. Распространение инфекции кровососущими членистоногими, такими как блохи, считается основным способом передачи. Однако, такой способ был показан экспериментально лишь однажды, и кошка пережила это без клинических или гематологических изменений. Было предположено, что M. haemofelis может передаваться от кошек котятам без участия членистоногих. Происходит ли трансмиссия в матке во время родов или в послеродовой период, неизвестно, потому как экспериментальные исследования на этот счет очень скудны. Ятрогенная передача может происходит при трансфузии крови от клинически здоровых носителей.
Тяжесть гемобартонеллеза варьирует, некоторые кошки имеют умеренную анемию без клинических признаков, а другие болеют с выраженной депрессией и серьезной анемией, приводящей к смерти. Для простоты понимания заболевание патогенез был разделен на препаразитемическую, острую, стадию выздоровления и стадию носительства (Рис. 6). Стадия препаразитемии длится около 1-3 недель после внутривенной инъекции. Острая фаза заболевания затрагивает период от появления паразитемии до ее окончания. Они обычно длится месяц и более, но часто кошки быстро гибнут от массивной паразитемии и снижения гематокрита в начале заболевания. Микроорганизмы появляются в крови циклично с прерывистыми эпизодами паразитемии. Их число растет до пиковых значений за 1-5 дней с последующим быстрым снижением. Синхронизированное исчезновение паразитов из крови может происходить в течение 2 часов и меньше. Микроорганизмы не удается найти или их совсем мало в мазках крови в течение нескольких дней после эпизода паразитемии, но небольшое их количество можно обнаружить методом ПЦР.
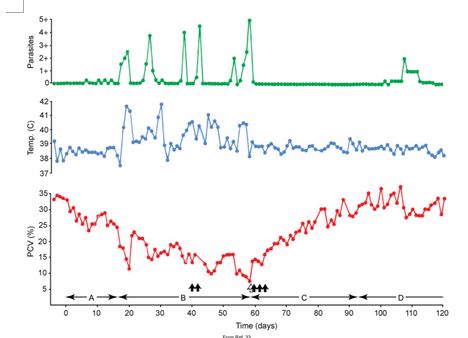
Рис. 6. Ежедневные измерения гематокрита, температуры и количества паразитов у кошки после внутривенной инокуляции крови с M. haemofelis с 0 дня. Темные стрелки указывают на внутривенное введение тиацетарсамида натрия (1мг/кг). Белая стрелка на 60 день указывает на трансфузию 25 цельной крови. Фазы гемобартонеллеза отмечены буквами: А – препаразитемия, В – острая фаза, С – фаза выздоровления и Д – фаза носительства.
Во многих случаях быстрое снижение гематокрита с последующим быстрым ростом происходит в связи с появлением и исчезновением большого количества паразитов из крови. Эти колебания гематокрита происходят из-за секвестрации селезенкой пораженных эритроцитов и высвобождением неинфицированных эритроцитов. В других случаях гематокрит остается низким или продолжает снижаться еще 1 день или дольше после эпизода паразитемии, возможно, в результате разрушения эритроцитов.
Повторяющиеся эпизоды паразитемии похоже вызывают прогрессивное разрушение эритроцитов и укорочение продолжительности их жизни. Небольшое повреждение эритроцитам наносится самими микроорганизмами, но более важны повреждения, обусловленные иммуноопосредованными механизмами. Тест Кумбса (прямой антиглобулин, 37◦ C) может иметь положительный результат спустя неделю после первой паразитемии, и, обычно, проба Кумбса остается положительной во время острой фазы заболевания, независимо от того, присутствуют ли микроорганизмы. Антитела к эритроцитам, действующие при 4◦ C ( иммуноглобулин G и M, холодовые антитела) появляются спустя 8-22 дня после экспериментальной инфекции M. haemofelis и персистируют 2-4 недели, в то время как тепловые агглютинины (37◦ C) появляются позже – между 22 и 29 дней и персистируют до 5 недель. Авторы этого исследования предположили, что антитела к эритроцитам скорее возникают как следствие микоплазменной инфекции и/или гемолиза, чем связаны с анемией. Прикрепление микроорганизмов к эритроцитам или выставляет спрятанные антигены эритроцитов или приводит к изменению антигенов эритроцитов с последующим ответом макроорганизма в виде антиэритроцитарных антител. Специфические антитела против антигенов M. haemofelis были обнаружены в сыворотке через 14 дней после экспериментального инфицирования. Однако и другой возможный механизм иммуноопосредованного повреждения можно предполагать. Если происходит фиксация комплемента, эритроцитарная мембрана может быть повреждена как «невинный свидетель». Однако в таком случае происходит минимальный интраваскулярный гемолиз. Анемия возникает первично из-за экставаскулярного эритрофагоцитоза макрофагами селезенки, печени, легких и ККМ. В сравнении с инфекцией Mycoplasma haemofelis, ни холодные, ни теплые антитела не были обнаружены у кошек с Candidatus M. Haemominutum и Candidatus M. Turicensis.
Как лимфоцитарный и макрофагальный фильтр крови, селезенка имеет большое значение в очистке антигенов крови и выработке специфического иммунного ответа на эти антигены. Результаты ПЦР показывают, что ткани селезенки и легких содержат больше M. haemofelis, чем другие ткани, в сравнении с уровнями в крови. Однако циклическое повышение числа паразитов в крови скорее вызвано быстрой репликацией, чем высвобождением после секвестрации. Кроме кошек, у других животных для возникновения клинической болезни (многими гемотропными микоплазмами) необходима спленэктомия. Избавление от микроорганизмов M. haemofelis у кошек после спленэктомиии происходит тяжелее и связано с вдвое более долгими периодами паразитемии, чем у кошек с селезенкой. Однако спленэктомия, проведенная перед инфицированием, не влияет на инкубационный период и тяжесть заболевания. Спленэктомия у выздоровевших кошек приводит к временной паразитемии, но у большинства животных гематокрит не снижается до клинически значимого уровня.
Без терапии треть кошек с неосложненной острой инфекцией M. haemofelis погибают вследствие серьезной анемии. Кошки с достаточным иммунным ответом на инфекцию и высоким регенеративным ответом красного костного мозга, компенсирующим разрушение эритроцитов, выздоравливают. Период выздоровления – время от последней крупной паразитемии до стабилизации гематокрита до или близко к нормальному уровню – занимает месяц или больше. У кошек без терапии микроорганизмы обнаруживаются в небольшом количестве в период выздоровления, но обычно это не вызывает дискретных эпизодов паразитемии.
Кошки, выздоровевшие после острого гемобартонеллеза, остаются хронически инфицированными на месяцы, годы или на всю жизнь. Тогда как экстрацеллюлярные микроорганизмы должны быть уничтожены иммунными механизмами, неповрежденные микроорганизмы, как сообщается, могут оставаться в фагоцитарных вакуолях макрофагов селезенки и легких. Некоторые микроорганизмы могут выживать в этих клетках, что будет считаться хронически инфекционным состоянием (однако исследования in situ инфекционных кошек с использованием специфических проб ДНК показали наличие микроорганизмов только на эритроцитах). Сообщение о внутриклеточном расположении других гемоплазм интригует, потому как это может увиливать защиту и служить источником хронической инфекции. Кошки-носители (с латентной инфекцией) выглядят клинически здоровыми. Они могут иметь нормальный гематокрит или небольшую регенераторную анемию. Небольшое количество микроорганизмов регулярно обнаруживают у некоторых таким кошек в мазках крови в течении нескольких недель. Кошки-носители имеют некоторое стабильное состояние баланса между репликацией микроорганизмов и фагоцитозом и уничтожением инфекции.
M. haemofelis может быть условно-патогенным агентом у здоровых кошек, вызывая заболевание у кошек заболевание в связи со стрессом другой болезни или хирургическими процедурами; однако, некоторые кошки с гемотропным микоплазмозом не имеют явного другого предрасполагающего заболевания или стресс-состояния. Абсцессы кусаных ран кошек похоже являются самой частой предрасполагающей причиной гемотропного микоплазмоза, возникающего через несколько недель. Несмотря на то, что абсцесс, конечно, это стресс-фактор, стоит предполагать возможность трансмиссии заболевания через кошачий укус. Исследования показали, что Mycoplasma haemofelis не может быть обнаружена в слюне или слюнных железах инфекционных кошек. Таким образом, социальные контакты и груминг маловероятно приводят к трансмиссии, однако, это по-прежнему не исключает возможность передачи при агрессивных взаимодействиях с помощью крови или чрезкожной инокуляции зараженных фекалий блох с шерсти инфицированных кошек. Другие факторы, увеличивающие вероятность нахождения микоплазмы в мазках – мужской пол, отсутствие вакцинаций, выгул, положительные результаты тестов на ВЛК и ВИК.
Интересна возможная связь между гемобартонеллезом и индуцированной ВЛК болезнью. Около 40-50% с клиническим гемотропным микоплазмозом оказываются ВЛК положительными. ВЛК может супрессировать нормальный иммунный ответ на другие агенты, таким образом, эта вирусная инфекция может повышать предрасположенность кошек к гемотропному микоплазмозу или переводить латентную инфекцию в клинически проявляющееся заболевание. Однако, ВЛК-инфицированные кошки в Бразилии не были более предрасположены к M. haemofelis, чем свободные от ВЛК.
Экспериментальые исследования показали, что обратное тоже может случиться – гемобартонеллез может повысить предрасположенность кошек к ВЛК инфекции. ВЛК и ВИК инфекции кошек в США были сильно ассоциированы с инфекцией M. haemofelis, что подтверждает такую взаимосвязь. Инфекция совместно ВЛК и M. haemofelis приводит к более серьезной анемии и клиническим признакам, чем одиночные агенты. В противоположность, конкурентная инфекция ВИК и M. haemofelis по всей видимости не приводит к более серьезной анемии, чем только M. haemofelis.
Доступен все больший объем информации касательно патогенеза Candidatus M. haemominutum. Инфекция этой микоплазмой часто протекает без симптомов и серьезной анемии, чаще наблюдается статус носителя. Интересно, что существенная паразитемия может возникать с небольшим изменением гематокрита.. Однако, в одном исследовании небольшое снижение гематокрита было продемонстрировано после экспериментальной инфекции Candidatus M. haemominutum, что позволяет предположить, что этот микроорганизм может индуцировать разрушение эритроцитов. Пик количества копий ДНК микроорганизма наблюдался около 30 дня, но значимой вариации в их числе не было обнаружено. Есть также сообщения о Candidatus M. haemominutum как единственной обнаруженной причине анемии естественно инфицированных кошек.
Кофакторы могут играть роль в развитии клинически значимого гемобартонеллеза, связанной с инфекцией Candidatus M. haemominutum. В одном более старом исследовании возможность выгула, кожный плоскоклеточный рак и стоматит были идентифицированы как риск-факторы инфекции. Несколько исследований показали, что кошки с ВИК и дикие кошки имеют больший риск иметь инфекцию. Как было описано по поводу M. haemofelis ранее, кошки, коинфицированные ВЛК и Candidatus M. haemominutum, имеют более серьезную анемию, чем только с Candidatus Mycoplasma haemominutum. В дополнение, стресс от инфекции Candidatus M. haemominutum может индуцировать развитие миелопролиферативных заболеваний у ВЛК-инфицированных кошек.
Некоторые исследования показывают, что инфекция Candidatus M. haemominutum защищает от инфицирования вирулентной M. haemofelis, однако, другие исследования говорят о том, что кошки хронически инфицированные Candidatus M. haemominutum, не защищены от M. haemofelis. Эти последние исследования также указывают о том, что при инфицировании двумя подвидами анемия более серьезна, чем только при M. haemofelis. Предыдущая инфекция одним подвидом может предрасполагать кошек к повышенному иммуноопосредованному ответу, когда они инфицируются другой разновидностью.
Информации о патогенезе Candidatus M. turicensis мало, это уникальна гемоплазма, выделенная из крови кошек с серьезной анемией. Ее трансмиссия с помощью внутривенной инокуляции предрасположенным кошкам привела к анемии от умеренного до серьезного уровня. Пик паразитемии, измеренный с помощью ПЦР, возникает через 16-18 дней после экспериментального инфицирования, но очевидного увеличения объема гемоплазм не обнаруживается (?). Характерных включений, похожих на микоплазм, не было обнаружено в мазках крови. У естественно инфицированных кошек небольшое число копий Candidatus M. turicensis обнаруживается в крови. Похоже, что возможна элиминация Candidatus M. turicensis без лечения инфицированных кошек.
Candidatus M. turicensis также была обнаружена в слюну и фекалиях инфицированных кошек с помощью молекулярных техник. Однако, инокуляция слюны, положительной на гемоплазму, ороназальным и подкожным путем не привела к инфицированию кошек. Исследования показывают, что коинфекция ВИК и иммуносупрессия могут повысить потенциальную патогенность микроорганизма. Candidatus M. turicensis инфекция часто была ассоциирована коинфекцией другими гемоплазмами, особенно Candidatus M. haemominutum.
Гемобартенеллез собак
Трансмиссия Mycoplasma haemocanis с помощью коричневого собачьего клеща (Rhipicephalus sanguineus) была продемонстрирована экспериментально. Также была описана трансстадийная и трановариальная передача возбудителя у клещей, что указывает на то, что клещи могут быть важным резервуаром и переносчиком инфекции. Ятрогенная трансмиссия M. haemocanis с помощью крови от клинически здоровых носителей (собак) также происходит, но имеет меньшее значение, чем у кошек, потому как собака-реципиент обычно должна быть спленэктомирована прежде чем клинически значимая болезнь может возникнуть. Гемотропный микоплазмоз, приведший к смерти двух животных от выводка 4-месячных щенков был описан. Экспериментальные исследования не смогли доказать возможность трансмиссии микоплазмоза щенкам через матку или при кормлении, но косвенное подтверждение для внутриматочной трансмиссии было обнаружено. Передача инфекции с помощью перорального введения инфицированной крови также было задокументировано.
Инкубационный период после внутривенного введения инфицированной крови спленэктомированным собакам составляет от 1-2 дней до 2 недель или больше. Некоторые случаи гемобартонеллеза характеризовались быстрым прогрессированием анемии, ассоциированной с почти постоянной паразитемией. Смерть таких собак обычно наступает через месяц после инокуляции. У других собак развитие анемии более постепенное с повторяющимися эпизодами паразитемии. Микроорганизмы обнаруживаются в больших количествах в крови в течение недели или дольше с небольшими перерывами, когда м/о не обнаруживаются. Проходит около 1-2 месяцев до снижения гематокрита и гемоглобина до минимальных значений, и примерно такое же время нужно, чтобы они поднялись до нормы. Несмотря на то, что иммунологическое обследованием этих собак было ограничено, предполагается, что образуются антитела к эритроцитам.
Для развития клинически значимого гемотропного микоплазмоза у собак обычно требуется спленэктомия. Однако, были описаны и случаи неспленэктомированных собак с конкурентными инфекциями: эрлихиозом, бабезиозом, бактериальными и вирусными инфекциями. Гемотропный микоплазмоз также возможен у собак, получающих иммуносупрессивные препараты, и с патологиями селезенки. Редкие случаи острого заболевания были задокументированы у собак без спленэктоми, у которых не было обнаружено доказательств иммуносупресии.
В отличие от инфекции M. haemofelis у кошек, большинство неспленэктомированных собак, инфицированных M. haemocanis не развивают клинического заболевания. Они не становятся анемичными и не имеют значимого числа паразитов в крови, которое можно было бы обнаружить в мазках крови. Есть молекулярные доказательства, что хроническая или латентная инфекция M. haemocanis часто бывает у выращенных в питомниках биглей. Но неизвестно, имеет ли значение в передачи инфекции трансплацентарная передача или поедание крови или артроподы или генетическая предрасположенность. Тем не менее, наличие хронической инфекции M. haemocanis может значимо влиять и спутывать результаты исследований, особенно при использовании спленэктомированных питомниковых биглей.
Клинические признаки
Симптомы и признаки гемобартонеллеза у кошек
Клинические признаки гемоплазменной инфекции варьируют и зависят от вовлеченных видов. В дополнение к этому влияет, является ли инфекция острой или хронической, есть ли сопутствующие заболевания или стресс. В сравнении с острой инфекцией M. haemofelis, лишь небольшое количество клинических признаков может быть обнаружено у кошек с субклинической инфекцией и анемия, если есть, то умеренная.
Острый гемобартонеллез возникает у кошек в любом возрасте. Но среди инфицированных кошек молодые более часто проявляют клинически значимую болезнь. Некоторые исследования показали более частые случаи и взрослых котов, что связали с их выгулом и драками, приводящими к более частой экспозиции с кошками, инфицированными M. haemofelis. Кошачий гемотропный микоплазмоз – обычно индивидуальное заболевание кошек, но случаи множественной инфекции в многокошковых () домах были доложены.
Наиболее частые симптомы при острой инфекции гемобартонеллеза у кошек с анемией – это тахипноэ, депрессия, вялость, анорексия, снижение веса, бледность слизистых оболочек и дегидратация. Также сообщалось о спленомегалии, которая, видимо, связана с экстраваскулярным разрушением эритроцитов и возможным экстрамедуллярным гематопоэзом. Только когда разрушение эритроцитов очень значимое и происходит быстро, может наблюдаться желтуха. Клинические признаки, как упомянуто выше, зависят от стадии заболевания и скорости развития анемии. Если анемия развивается постепенно, кот пожжет терять вес, но оставаться активным. В противовес этому, быстрое снижение гематокрита в начале заболевания вместе с выраженной паразитемией вызывает незначительное снижение веса, но значимую депрессию и другие признаки анемии. Ректальная температура обычно в норме, кроме как при острой фазе заболевания, когда она повышена примерно 50% времени. Пониженная температура может наблюдаться у кошек при смерти.
У кошек с Candidatus Mycoplasma haemominutum симптомы гемобартонеллеза умеренные или их нет. Небольшая лихорадка может возникать временами. Инфекция Candidatus M. haemominutum была обнаружена чаще у больных кошек, чем у здоровых, но непонятно связаны ли симптомы с инфекцией Candidatus M. haemominutum или сопутствующей болезнью. В одном сообщении Candidatus M. haemominutum была единственной обнаруженной причиной анемии у нескольких естественно инфицированных кошек.
Candidatus M. turicensis, новая открытая гемоплазма, может быть патогенной у кошек и вызывать гемолитическую анемию от умеренной до тяжелой. Есть более ранние доклады, указывающие, что клинические признаки более тяжелые у кошек с коинфекцией ВИК или после приема ГКС.
Клинические признаки гемобартонеллеза у собак
Если нет других сопутствующих заболеваний, клинические признаки неявны у неспленэктомированных собак, инфицированных Mycoplasma haemocanis или Candidatus M. haematoparvum. Спленэктомированные собаки, экспериментально инфицированные M. haemocanis, становились вялыми, с прогрессированием анемии их слизистые становились бледными, но обычно они имели нормальную ректальную температуру и аппетит. Спустя 1 неделю обнаружения в крови Candidatus M. haematoparvum у спленэктомированной собаки с лимфоидной неоплазией развилась серьезная регенераторная анемия, о клинически признаках в этом единственном сообщении нет данных.
Диагностика
Лабораторные данные относительно гемобартенеллеза у кошек
Микроорганизмы Mycoplasma haemofelis, которых можно обнаружить в мазках крови, присутствуют в крови только около 50% времени острой фазы заболевания гемобартонеллеза. Гематокрит обычно опускается ниже 20%, часто ниже 10% до того, как симптомы заболевания становятся заметны владельцу. Гематокрит наиболее надежный индикатор общей эритроцитарной массы у кошек с гемотропным микоплазмозом. Эритроциты с паразитами, которые в основном изолированы в селезенке и других органах могут возвращаться в общий кровоток после удаления микроорганизмов с их поверхности.
Если гематокрит снижается быстро (менее чем за 4 дня до обнаружения, средний объем эритроцитов может быть в референсном интервале с небольшим количеством ретикулоцитов. К тому времени, как проявляются клинические признаки, кошки имеют регенераторную анемию с полихромазией и ретикулоцитозом. Эритроциты обычно макроцитарные со средним объемом эритроцитов более 50 fL и обычно гипохромные со средней концентрацией гемоглобина менее 31 g/dL. Хотя, анизоцитоз, ядерные эритроциты и повышенное число телец Хауэлла-Жолли часто обнаруживают в острой фазе кошачьего гемотропного микоплазмоза, эти данные не являются надежными индикаторами регенераторного ответа у кошек. Тельца Хауэлла-Жолли часто обнаруживаются у здоровых кошек, ядерные эритроциты могут обнаруживаться при многих других заболеваниях, значимый анизоцитоз без полихромазии обнаруживается у кошек с миелопролиферативными заболеваниями. Кошки с латентной инфекцией (носители) при гемобартонеллезе обычно имеют небольшое количество м/о, видимых в крови. Их гематокрит колеблется время от времени, он может быть нормальным или немного сниженным, однако не менее 20%. Небольшой ретикулоцитоз с полихромазией и повышенным средним объемом эритроцитов присутствует временами.
Так как существует две морфологические формы ретикулоцитов у кошек описано у кошек, важно знать, какие критерии использует лаборатория для подсчета ретикулоцитов. Агрегатные эритроциты составляют небольшую часть эритроцитов крови обычных кошек (0-0,4%). Процент этих форм хорошо коррелирует с процентом полихроматофильных эритроцитов. Большее число циркулирующих эритроцитов составляют пунктатные ретикулоциты (до 10%), которые содержат пунктатные включения преципитированных рибосом. Число ретикулоцитов у кошек с тяжелой паразитемией тяжело точно оценить, так как м/о тоже окрашиваются как голубые включения, как и пятна ретикулоцитов.
Общее и дифференциальное число лейкоцитов вариабельно, ограниченную диагностическую ценность может иметь повышенная реактивность моноцитов. При сканировании под малым увеличением можно обнаружить эритрофагоцитоз с помощью моноцитов или макрофагов. Число тромбоцитов обычно в норме.
Фагоцитоз эритроцитов мононуклеарными клетками в кровотоке происходит из-за образования антител, реакции комплемента или обоих на поверхности эритроцитов. Аутоагглютинация часто обнаруживается в охлажденных образцах крови на ранних стадиях гемотропного микоплазмоза, но клиническая значимость этих холодовых агглютининов иммуноглобулинов М неясна. Результаты теста Кумбса (37◦ C) часто положительны на тот момент, когда проводится обследование пациента. Согласно предыдущим находкам, все экспериментально инфицированные кошки с гемобартонеллезом в одном исследовании имели или персистентную аутоагглютинацию промытых эритроцитов или положительную пробу Кумбса в какой-то момент клинической оценки. Однако никто из кошек, экспериментально зараженных Candidatus Mycoplasma haemominutum или Candidatus M. turicensis не имел положительных результатов пробы Кумбса.
Соотношение миелоидного к эритроидному ростку (М:Е) в красном костном мозге в норме в начальных стадиях инфекции Mycoplasma haemofelis, но значительно снижается позднее при заболевании. Эритроидная гиперплазия происходит не только из-за увеличения общего числа эритроцитов, но и из-за увеличения пропорции незрелых форм. Эритрофагоцитоз макрофагами от слабого до серьезного уровня обычно присутствует.
Иктеричность плазмы не всегда обнаруживается при гемобартонеллезе кошек, но она может присутствовать спустя 1-2 дня после быстрого снижения гематокрита. Иктеричность и увеличение концентрации билирубина не всегда следует за быстрым снижением гематокрита, возможно, из-за того, что эритроциты могут быть секвестрированы в капиллярах или сосудистых пространствах в пределах селезенки без их разрушения. Концентрация белка обычно в норме (6-9 g/dL), но может быть повышена у некоторых кошек. Сывороточная концентрация АЛТ и АСТ обычно умеренно повышена. Эти изменения могут быть связаны с гипоксией печени вторично к анемии или липидозом вторично к анорексии. Концентрация мочевины может быть немного или сильно повышена без одновременного повышения креатинина. Повышение мочевины, считается, связано с преренальным, вторично к дегидратации. Умирающие кошки могут иметь низкий уровень глюкозы.
Кошки, инфицированные Candidatus M. haemominutum могут иметь слабо регенераторную анемию или нормальные гематологические показатели. Ранние исследования показали, что Candidatus M. turicensis может быть патогенным, вызывая умеренную или сильную гемолитическую анемию. В одном исследовании, проведенном в Соединенном Королевстве, не было обнаружено связи гемоплазменной инфекции и положительной по пробе Кумбса анемии у кошек.
Лабораторные изменения в организме собак при гемобартонеллезе
Когда присутствуют клинические признаки анемии, вызванной гемотропным микоплазмозом, Mycoplasma haemocanis обычно обнаруживают. Однако анемия варьирует от умеренной до серьезной в исследованиях спленэктомированных собак, гематокрит обычно снижается менее 20% до возникновения клинических признаков. Микроорганизмы могут быть обнаружены временами при исследовании крови собак с клиническими признаками других конкурентных заболеваний.
В большинстве случаев значительное время проходит до возникновения анемии от первичного обнаружения заболевания, до развития регенераторного ответа красного костного мозга на анемию. Гематологические изменения включают ретикулоцитоз с повышением полихромазии и анизоцитоза, циркуляцией ядерных эритроцитов и часто тельцами Хауэлла-Жолли. Нужно больше времени для развития макроцитоза, то есть, его может не быть, когда ветеринар сначала обследует животное.
Изменений в лейкограмме обычно не обнаруживают при гемотропном микоплазмозе. Ни иктеричности плазмы, ни гемоглобинемии обычно не возникает в неосложненных случаях гемобартонеллеза, но может возникнуть существенная билирубинурия. Сфероцитоз и положительная проба Кумбса возникают у некоторых собак. Однако, в одном исследовании на собаках из Англии, не было обнаружено связи между гемотропным микоплазмозом и положительной по пробе Кумбса анемией. Собаки с латентной инфекцией обычной имеют нормальные результаты гематологического исследования.
Обнаружение микроорганизма и нуклеиновой кислоты возбудителя гемобартенеллеза у кошек
Для идентификации гемотропных микоплазм требуются тонкие, хорошо-окрашенные мазки крови без артефактов, связанных с неправильной сушкой или фиксацией и остатками краски. Многие модификации красок Романовского (например, Wright-Giemsa) можно использовать, однако микроорганизмы сложно обнаружить, используя Diff-Quik. Мазки должны быть исследованы до лечения гемобартонеллеза, так гемоплазмы отсутствуют в крови у кошек, получавших тетрациклины. Микроорганизмы могут открепляться от эритроцитов во время хранения в ЭДТА, поэтому следует проводить исследование как можно быстрее после взятия образца крови. Клиницист должен мочь отличить микоплазм от частиц краски, артефактов сушки, телец Хауэлла-Жолли, базофильной зернистости, сидеротических включений и паразитов Cytauxzoon, которые являются мелкими простейшими с цитоплазмой и ядрами (Табл. 1). Не должны использоваться препараты метиленового синего, а также окрашенные ретикулоциты не должны использоваться для диагностики гемотропного микоплазмоза, потому как здоровые кошки тоже имеют до 10% пунктатных эритроцитов, и преципитированный рибосомный материал в ретикулоцитах нельзя точно отличить от микоплазм.
Потому как паразитемии цикличны, отсутствие M. haemofelis в мазках крови не исключает инфекцию. Регенераторная анемия с положительным тестом Кумбса, наличие аутоагглютинации в охлажденных пробах крови или эритрофагоцитоза моноцитами позволяет предполагать инфекцию M. haemofelis. Однако, другие гемоплазмы и заболевания, например, первичная иммуноопосредованная гемолитическая анемия, также стоит предполагать.
Candidatus Mycoplasma haemominutum редко видны в крови, а когда обнаруживаются их сложно идентифицировать, так как они очень маленькие. Candidatus M. turicensis не были окончательно обнаружены в мазках крови.
Высокочувствительные ПЦР исследования обнаруживают небольшое количество гемоплазм в крови, когда сложно установить диагноз используя мазки крови из-за слишком небольшого чиста паразитов. Обратная ПЦР разработана для диагностики M. haemofelis и Candidatus M. haemominutum и одна для Candidatus M. turicensis. Есть также ПЦР в реальном времени для обнаружения и подсчета всех типов гемоплазм.
С использованием сравнительной и количественной ПЦР было установлено, что примерно 50 копий (микроорганизмов) M. haemofelis могут быть обнаружены с помощью ПЦР. С помощью SYBR green ПЦР можно обнаружить от 1 до 10 ДНК копий, а также возможно определение видоспецифичности с анализом кривых плавления. Специфические ПЦР праймеры были разработаны для дифференциации M. haemofelis и Candidatus M. haemominutum для расширенных ДНК продуктов. Результаты ПЦР были положительными 4-115 дней после экспериментальной инфекции и результаты оставались положительными до начала специфической антимикробной терапии. Результаты ПЦР отрицательны во время антмикробной терапии, но большинство кошек снова имели положительные результаты ПЦР через 3-5 недель после окончания терапии, но небольшое количество кошек имели отрицательные результаты в течение 6 месяцев после лечения. С использованием количественной ПЦР было обнаружено, что концентрация M. haemofelis в крови обратно пропорциональная гематокриту инфицированных кошек.
Диагноз при гемобартонеллезе обычно ставится на основании обнаружения м/о в крови или с помощью ПЦР. Однако, ELISA метод для обнаружения антител к кошачьим микоплазмам тоже был разработан. Тесты были положительны у кошек, инфицированных M. haemofelis, Candidatus Mycoplasma haemominutum и Candidatus Mycoplasma turicensis, у а неинфицированных нет.
При обнаружении микроорганизмов в мазках крови или методом ПЦР, все равно серьезность гемоплазменной инфекции должна быть оценена в свете гематологических и клинических данных. Просто обнаружение микроорганизмов в крови не обязательно указывает, что существующая клиническая болезнь вызвана этим агентом, потому как м/о могут быть периодически обнаружены у носителей без заболевания. С другой стороны, если анемия оказывается нерегенераторной, клиницист не должен совсем исключать значимость микрооргаизмов у кошек. Если гематокрит падает стремительно после инфекции, кошка может быть вялой или анемичной несколько дней до развития значимого регенераторного ответа красного костного мозга, обнаруживаемого в периферической крови. Однако, при постоянной нерегенераторной анемии клиницист должен искать другие причины анемии, такие как ВЛК и ВИК инфекции.
Исследование методом ПЦР полезно при тестировании клинически здоровых кошек-доноров или при введении их в колонии, свободные от патогена. В Американском Колледже Ветерианрной Интернальной Медицины было рекомендовано скринингово исследовать всех доноров на гемобартонеллез. Хотя и не указано, исследование проводится методом ПЦР, как более чувствительным, чем микроскопия. Кошки в приютах, гуляющие кошки или после контакта с блохами, исследованные перед донорством методом ПЦР, имели более высокую распространенность инфекции. Оказалась возможна передача гемобартонеллеза кошкам с помощью инфицированной крови, хранившейся в растворе CPDA-1 антикоагулянта, спустя 1 час после хранения, а крови, инфицированной Candidatus M. haemominutum, может передавать инфекцию спустя 1 неделю. ПЦР исследования также оказались полезными в эпидемиологических исследованиях по разнообразию и распространенности инфекции в популяциях кошек.
Табл. 1. Цитологические неточности в обнаружении гемотропных микоплазм кошек.
| Причины | Представление | Исправление |
| Ложноположительные | ||
| Преципитаты краски | над фокальной плоскостью, больше и более глубокое окрашивание, разный размер | используйте свеже-фильтрованные краски |
| Артефакты сушки | неровные края, не изменяются при фокусировке | делайте тонкие мазки, сушите быстро |
| Тельца Хауэлла-Жолли | больший размер (1-2 μm), ремнанты ядер | нет |
| Сидеротические включения | хорошо фокусируются, гранулы, окрашенные синим | Положительно при окрашивании Прусской синей краской |
| Ложноотрицательные | ||
| Временная паразитемия | отсутствие м/о несмотря на регенераторную анемию | ПЦР исследование |
| Избыток или длительная экспозиция ЭДТА | отсутствие м/о несмотря на регенераторную анемию | Новый свежий образец, гепарин или без антикоагулянта |
Обнаружение возбудителя гемобартенеллеза у собак
Mycoplasma haemocanis может быть обнаружен в крови собак с клинически значимым гемотропным микоплазмозом, однако м/о может быть мало и их трудно найти. Как и у кошек, клиницист должен дифференцировать микроорганизмы и артефакты окрашивания, базофильной зернистости, телец Хауэлла-Жолли. Наиболее полезный критерий – тенденция M. haemocanis к образованию цепей из микроорганизмов поперек поверхности эритроцитов. Размером около 0,3μm Candidatus M. haematoparvum, эти микроорганизмы могут быть легко пропущены. Они обычно обнаруживаются в числе 3-4 кокков на один эритроцит или в парах, но кольцевидных форм и цепей не было описано. Мазки крови должны исследоваться тщательно, если анемия развивается или становится более серьезной у собаки после спленэктомии.
Разработана ПЦР для обнаружения M. haemocanis. Эти исследования достаточно чувствительны для обнаружения и субклинической инфекции при гемобартонеллезе. Количественные ПЦР методы также разработаны для M. haemocanis и Candidatus M. haematoparvum.
Патологоанатомические изменения гемобартонеллеза у животных
Данные патологоанатомического исследования кошек при гемобартонеллезе включают бледность тканей во всех случаях, истощение примерно в 75% случаев, небольшую или значимую спленомегалию у 50%, и умеренную или серьезную желтушность у некоторых кошек.
Гистологические изменения варьируют и включают эритроидную и иногда миелоидную гиперплазию в ККМ и пассивную перегрузку, экстрамедуллярный гематопоэз, фолликулярную гиперплазию, эритрофагоцитоз и повышение гемосидерина в селезенке. В некоторых случаях наблюдается жировая дистрофия и центродолевой некроз печени.
Данных о патологоанатомических изменениях при гемобартонеллезе у собак мало. Кровь кажется более разбавленной, а ткани бледными. ККМ красный и желеобразный. Может присутствовать гиперплазия мононуклеарной фагоцитарной системы.
Лечение кошек при гемобартонеллезе
Антимикробная терапия гемобартонеллеза снижает или элиминирует обнаруживаемую паразитемию, но полностью не избавляет животное от микроорганизма. Несмотря на то, что доксициклин, энрофлоксацин, марбофлоксацин снижают клинические признаки и количество м/о у инфицированных кошек, эти антибиотики не полностью избавляют от гемоплазм.
Лечение инфекции Mycoplasma haemofelis фторхинолоном прадофлоксацином может обеспечить более эффективное длительное избавление от инфекции, чем доксициклин. Доксициклин (10 мг/кг перорально, каждый день) или тетрациклин/окситетрациклин нужно давать 3 недели (Табл. 2). К сожалению, тетрациклиновые антибиотики могут вызывать лихорадку, заболевания ЖКТ (например, стриктуру пищевода) у кошек. Предварительные данные указывают, что энрофлоксацин (5 мг/кг, перорально, 1 раз в день) в течение 2 недель может быть эффективной альтернативой для кошек, которые не переносят тетрациклины. Более высокие дозы энрофлоксацина не рекомендованы из-за риска дистрофии сетчатки и слепоты. Использование марбофлоксацина (2 мг/кг, перорально, ежедневно) также оказалось эффективным для лечения M. haemofelis, но гораздо менее эффективен относительно Candidatus Mycoplasma haemominutum. Азитромицин или имидокарб дипропионат неэффективны в лечение гемотропных микоплазм кошек.
Хлорамфеникол, рекомендованный ранее для лечения M. haemofelis, не должен использоваться с этой целью, потому как вызывает дозо-зависимую эритроидную гипоплазию в ККМ кошек. О лечении Candidatus Mycoplasma turicensis нет или очень мало данных.
Глюкокортикоиды, такие как преднизолон (1-2 мг/кг, перорально каждые 12 часов), могут быть назначены животным с серьезной анемией, чтобы снизить эритрофагоцитоз. Доза ГКС должна быть снижена постепенно, когда гематокрит повышается. Гемотрансфузия необходима, когда анемия является жизнеугрожающей, Внутривенное введение растворов с глюкозой рекомендовано для кошек при смерти.
С лечением или без, когда животные выздоравливают от инфекции M. haemofelis, они обычно остаются носителями, и рецидив с клиническими признаками возникает редко, когда гематокрит возвращается к норме. После иммуносупресии ГКС, м/о по-прежнему могут быть обнаружены ПЦР.
Лечение собак, больных гемобартонеллезом
Экспериментальные исследования с лечением собачьего гемотропного микоплазмоза ограничены. Количественная ПЦР использовалась для мониторинга лечения спленэктомированной собаки. ДНК копии оставались в большом количестве несмотря на лечение, со снижением спустя 11 месяцев терапии в совокупности с клиническим и гематологическим улучшением. Организм никогда не исчезал из циркуляции во время лечения. Гемотрансфузия необходима, когда анемия является жизнеугрожающей. Есть сообщение об эффективном лечении инфекции M. haemocanis лечение пероральными формами тетрациклинами (Табл. 2). Собаки, выздоровевшие после гемотропного микоплазмоза, возможно, имеют латентную инфекцию. Данных о лечении Candidatus Mycoplasma haematoparvum нет.
Табл. 2. Дозы препаратов для лечения гемотропного микоплазмоза собак и кошек
| Название | Вид | Доза (мг/кг) | Метод введения | Интервал (часы) |
| Тетрациклин (или Окситетрациклин) | Собака | 20 (7,5-10) | п/о, в/в | 8 (12) |
| Доксициклин | Собака | 10 | п/о | 24 |
| Доксициклин | Кошка | 5 | п/о | 12 |
| Энрофлоксацин | Кошка | 5-10 * | п/о | 24 |
| Прадофлоксацин | Кошка | 5 | п/о | 24 |
| Марбофлоксацин | Кошка | 2,75 | п/о | 24 |
| Преднизолон | Собака, кошка | 1-2 ** | п/о | 12 |
* - дозы более 5 мг/кг могут быть ретинотоксичны у кошек, должны использоваться с осторожностью или с другими препаратами. У собак могут быть использованы те же дозы, согласно данным, основанным на одном случае.
** - назначение глюкокортикоидов необязательно. Кошки при экспериментальной инфекции отвечали на лечение тетрациклинами в монорежиме.
Профилактика гемобартонеллеза у кошек и собак
Профилактика в отношении кровососущих артропод собак и кошек рекомендована, так как они могут переносить инфекционные заболевания, включая гемотропный микоплазмоз. Ятрогенная передача инфекции Mycoplasma haemocanis у собак обычно возможна только, если реципиент был спленэктомирован. Ятрогенная передача инфекции может быть профилактирована исследованием ПЦР крови доноров кошек и собак.
Вопросы здравоохранения и гемобартонеллез человека
Гемотропные микроорганизмы, похожие на собачьи и кошачьи, были обнаружены при цитологическом исследовании крови людей с ослабленным иммунитетом. Однако, до появления молекулярно-генетических методов, эти инфекции с некультивируемыми м/о не были подтверждены. С использованием ПЦР при коинфекции ВИЧ Bartonella henselae и Mycoplasma haemofelis были обнаружены у человека из Бразилии. Конфекция B. henselae и м/о похожие на Mycoplasma ovis были обнаружены у ветерианара из Техаса. Mycoplasma suis были обнаружены у работников свинофермы в Китае. Эти случаи позволяют предполагать, что перенос инфекции может происходить через укусы, царапины, при обработки крови животных, приводя к инфекции гемоплазмами, особенно у людей с иммуносупрессией. Таким образом, должны соблюдаться меры профилактики для предотвращения риска передачи инфекции в таких условиях.
Литература
- Гемотропный микоплазмоз (гемобартонеллез) / Joanne B. Messick, John W. Harvey (Infectious diseases of the dog and cat, Greene, 2012)
^Наверх
Полезно знать
- Трихопол инструкция для ветеринарии
- Инструкция по применению антибиотика байтрила у животных
- Инструкция по применению метронида
- Инструкция к препаратам цефтриаксона для животных
- Использование метрогила в ветерианрной медицине
- Инструкция по доксициклину у животных
- Метронидазол (Metronidazole) для животных (инструкция по применению в ветеринарии, дозы, показания и противопоказания)
- Атоваквон (ATOVAQUONE)
- Азитромицин, инструкция для терапии животных









