Активность ренин-ангиотензин-альдостероновой системы у гипертироидных кошек с одновременной гипертензией и без нее

Информация об авторах: Виллиамс Т.Л., Еллиотт Й., Сайме Х.М.
Williams T.L., Elliott J., Syme H.M. Renin-angiotensin-aldosterone system activity in hyperthyroid cats with and without concurrent hypertension // J Vet Intern Med. 2013 May-Jun;27(3):522-9.
Аннотация
Предпосылки: Гипертензия присутствует у некоторых гипертиреоидных кошек при диагностике или может развиваться после лечения гипертиреоза. Активация ренин-ангиотензин-альдостероновой системы (РААС) может быть вовлечена в патогенез гипертонии. ГИПОТЕЗА: Гипертиреоидные кошки, у которых развивается гипертония до или после лечения гипертиреоза, будут иметь большую активацию ренин-ангиотензин-альдостероновой системы, чем нормотензивные кошки. ЖИВОТНЫЕ: Девяносто девять гипертиреоидных кошек. МЕТОДЫ: Ретроспективное исследование случай-контроль. Плазменную активность ренина (PRA) и концентрацию альдостерона в плазме (PAC) измеряли у необработанных гипертиреоидных кошек с гипертензией (группа HT-Pre), изначально нормотензивных гипертироидных кошек, у которых развивается гипертония после лечения (группа HT-Post) и гипертиреоидных кошек, которые являются нормотензивными (NT). Данные представлены в виде медианы [25, 75-й процентиль]. РЕЗУЛЬТАТЫ: Исходный уровень ренина (PRA) не был существенно различен среди 3 групп (группа HT-Pre 1.50 [0,05, 2,37] нг/мл/ч, группа HT-Post 0,66 [0,17, 2,31] нг/мл/ч, группа NT 1.11 [0,57, 2,18 ] нг / мл / ч, P = 0,44). Уровень ренина значительно снизился после лечения в группе NT (1,09 [0,53, 2,47] против 0,22 [0,05, 0,76] нг/мл/ч, P<0,001) и группы HT-Post (0,71 [0,17, 2,33] против 0,28 [0,07, 0,57] нг/мл/ч, P = 0,006). Исходная концентрация альдостерона не была существенно различной среди 3 групп (группа HT-Pre 72,2 [40,0, 145,6] пг/мл, группа HT-Post 69,7 [43,3, 142,6] пг/мл, NT-группа 109,0 [68,2, 184,6] пг/мл , P = .10). Концентрация альдостерона значительно снизилась после лечения в группе NT (114,4 [56,6, 204,1] против 59,5 [32,4, 98,2] пг / мл, P <0,001), но существенно не изменился в группе HT-Post (61,2 [44,9, 124,0] против 58,4 [42,0, 97,7] пг / мл, P = 0,59). ВЫВОДЫ И КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ: Активация ренин-ангиотензин-альдостероновой системы происходит у гипертироидных кошек, но не связана с развитием гипертонии. Альдостерон не зависит от изменений ренина у гипертироидных кошек, у которых развивается гипертония после лечения, возможно, указывая на дисфункцию ренин-ангиотензин-альдостероновой системы у этих кошек.
Сокращения
- ARR - альдостерон: ренин
- SBP - систолическое кровяное давление
- CKD- хроническая болезнь почек
- HT-Pre- гипертоническая болезнь при диагностике
- HT-Post гипертоническая посттерапия
- NT - с нормальным артериальным давлением
- PAC- концентрация альдостерона в плазме
- PRA - активность ренина в плазме
- РААС - система ренин-ангиотензин-альдостерон
- TT4 - общая концентрация тироксина в плазме
- USG - удельный вес мочи
Гипертензия присутствует у 14-23% кошек во время диагностики гипертиреоза [1,2]. Двадцать три процента изначально нормотензивных гипертиреоидных кошек также развивают гипертонию после лечения гипертиреоза и восстановления эутиреоидного состояния 1. Развитие гипертонии при гипертиреозе или после лечения при гипертиреозе может быть вторичным по отношению к наличию основного хронического заболевания почек (ХЗП), поскольку гипертония присутствует, по крайней мере, у 19% кошек с хроническим заболеванием почек (ХЗП) [1, 3, 4]. Азотемическое хроническое заболевание почек (ХЗП) присутствует у 11% гипертироидных кошек [2] и развивается у еще у 15-49% гипертиреоидных кошек после лечения [2, 5].
Хотя гипертония связана с хроническим заболеванием почек (ХЗП) у кошки [1, 3, 4], точный патофизиологический механизм (механизмы) и взаимосвязь между двумя патологическими состояниями еще недостаточно изучены [6, 7]. Стимуляция ренин-ангиотензин-альдостероновой системы ( РААС) происходит у пациентов с ХЗП [8-10], и это коррелирует с тяжестью гипертонии [10]. Активация ренин-ангиотензин-альдостероновой системы (РААС) через эффекты ангиотензина-II и альдостерона вызывает расширение объема, сосудосуживание и, как следствие, повышение артериального давления. У кошек с ХЗП и гипертонией активность ренина плазмы (PRA) сходна с клинически здоровыми кошками [6] или уменьшена по сравнению с нормотензивными кошками с ХЗП 2. Однако концентрация альдостерона в плазме крови выше у гипертензивных кошек с ХЗП по сравнению с нормальными кошками [6] и нормотензивные кошки с аналогичной степенью почечной дисфункции [6, 11].
Гипертиреоз вызывает активацию ренин-ангиотензин-альдостероновой системы (РААС) у людей [12-14]. Снижается системное сосудистое сопротивление при гипертиреоидном состоянии [15], что снижает эффективный объем заполнения артерий и стимулирует выделение ренина в качестве компенсаторного ответа. После восстановления эутиреоза системное сосудистое сопротивление возвращается к норме, и активация ренин-ангиотензин-альдостероновой системы (РААС) должна уменьшаться. Однако, если активация ренин-ангиотензин-альдостероновой системы (РААС) остается после восстановления эутиреоза, это может привести к развитию гипертонии после лечения. Хотя одновременная гипертензия распространена у кошек с гипертиреозом, патофизиологические механизмы развития гипертензии у кошек плохо изучены. В одном предварительном исследовании была измерена активация ренин-ангиотензин-альдостероновой системы (РААС) до и после лечения гипертиреоза у кошек с гипертонией и без нее 3, однако размеры групп были небольшими, поэтому трудно сделать какие-либо твердые выводы относительно роли ренин-ангиотензин-альдостероновой системы (РААС) в развитии гипертонии у кошек.
Первая цель этого исследования состояла в том, чтобы определить, была ли увеличена активация ренин-ангиотензин-альдостероновой системы у гипертироидных кошек с одновременной гипертензией во время диагностики по сравнению с первоначально нормотензивными гипертиреоидными кошками, у которых развивается гипертония после лечения и нормотензивными гипертироидными кошками. Вторая цель состояла в том, чтобы оценить изменения в активации ренин-ангиотензин-альдостероновой системы (РААС), которые возникают у первоначально нормотензивных гипертироидных кошек, у которых развивается гипертензия после восстановления эутиреоза и сопоставляются эти изменения с изменениями гипертиреоидных кошек, которые остаются нормотензивными. Активацию ренин-ангиотензин-альдостероновой системы (РААС) оценивали путем измерения концентрации ренина и альдостерона в плазме крови.
Методы
Выбор кошек для исследования
Были проанализированы записи из двух основных в Лондоне основополагающих практик (Народного диспансера для больных животных, больницы Бомонт Сейнсбери, Камден) в период с 1 января 1999 года по 30 марта 2011 года и выявлены новые диагностированные гипертиреоидные кошки. Диагноз гипертиреоза основывался на концентрации общего тироксина в плазме (ТТ4) больше, чем в лабораторном контрольном диапазоне (> 55 нмоль/л или 4,26 мкг/дл).
Кошки были исключены из дальнейшего анализа, если во время диагностики гипертиреоза они имели признаки предшествующей или одновременной азотемии (определенные ниже) или если они получали антигипертензивный препарат (амлодипин).
Кошек лечили от гипертиреоза с помощью антитиреоидных препаратов (карбимазол или метимазол) в отдельности или в сочетании с тиреоидэктомией и пересматривали примерно через 4 недели, пока эутиреоз не был восстановлен. После стабилизации кошек исследовали каждые 8-12 недель. Образцы крови и мочи были получены примерно каждые 3-4 месяца.
Измерение артериального давления
Измерения систолического артериального давления (SBP) проводились с помощью ультразвукового доплеровского зонда при ультразвуке с частотой 8,1 МГц, используя ранее описанный протокол [3]. Фундаментальное исследование косвенной офтальмоскопии проводилось у кошек со средним САД больше 160 мм рт.ст. для оценки наличия гипертонической ретинопатии.
Классификация гипертонии, азотемии и контроля гипертиреоза
Кошки были классифицированы как гипертензивные при постановке диагноза (группа HT-Pre), если они имели средний уровень САД более 160 мм рт. ст. с подтверждением гипертонической ретинопатии на исходном уровне. Кошки были также классифицированы как гипертензивные при постановке диагноза (группа HT-Pre), если они имели средний уровень САД более 170 мм рт. ст. без подтверждения гипертонической ретинопатии на исходном уровне, а гипертония была подтверждена повторным измерением артериального давления (САД более 170 ммг) во 2-м посещении в течение 1-2 недель (и клиницист не чувствовал, что гипертензия белого халата является значительным фактором). В случаях, когда сопутствующая гипертензия была диагностирована во 2-м посещении в течение 1-2 недель после постановки диагноза гипертиреоза, антитиреоидный препарат удерживали до тех пор, пока гипертония не была успешно контролирована антигипертензивным препаратом (амлодипин). Это считалось разумным, поскольку артериальное давление может увеличиться после лечения гипертиреоза 1, которое может усугубить одновременную гипертензию. Гипертиреоидные кошки, которые были нормотензивны во время диагностики, наблюдались в течение 6-месячного периода после установления эутиреоза. Кошки, у которых развилась гипертензия в течение 6 месяцев после начала лечения, классифицировались как гипертоническая посттерапия (группа HT-Post). Посещение, в котором кошка была диагностирована как гипертоничная (т.е. до начала лечения гипертонии), была определена как визит после лечения для группы HT-Post. Гипертиреоз не всегда хорошо контролировался (определяется ниже) при посещении после лечения для группы HT-Post. Кошки, которые оставались нормотензивными и хорошо контролируемыми (определенными ниже) в течение 6-месячного периода после установления эутиреоза, классифицировались как нормотензивные (группа NT), а время в конце 6-месячного периода определялось как посещение после лечения нормотензивных кошек. Любым кошкам, которым начали проводить почечную диету в течение периода наблюдения, также были исключены из исследования. Резонансная азотемия была определена как концентрация креатинина в плазме более 2,0 мг / дл (177 мкмоль / л) в сочетании с плотностью мочи менее 1,035 или постоянная азотемия в 2 или более раза подряд без клинических доказательств преренальной причины. Гипертиреоз был классифицирован так же хорошо контролируемым, если у кошек появился эутиреоид при клиническом исследовании (без тахикардии или потери веса) и имели серийные измерения T4 менее 40 нмоль/л (3,1 мкг / дл) для 6-месячного периода.
Отбор проб и обработка мочи. Образцы крови и мочи были собраны в рамках программы гериатрического скрининга и здравоохранения с согласия владельца. Комитет по этике и благосостоянию Королевского ветеринарного колледжа одобрил протокол диагностики. Образцы яремной венозной крови собирали и помещали в гепаринизированные и покрытые ЭДТА трубки, а образцы мочи собирали путем цистоцентеза. Образцы хранились при температуре 4 ° C перед обработкой образца, которая происходила в течение 6 часов после сбора проб. Образцы крови помещали в охлажденную центрифугу при приблизительно 2000 × g в течение 10 минут, чтобы обеспечить отделение плазмы от клеточных компонентов. Гепаринизированную плазму подавали в одну внешнюю лабораторию 4 для биохимического анализа, включая измерение общего T4. Избыток гепаринизированной и ЭДТА-плазмы хранился при -80 ° С до периодического анализа плазменного уровня ренина и альдостерона, который произошел через 11 лет спустя от первой пробы. Измерение активности плазменного ренина и концентрации плазменного альдостерона. Активность ренина плазмы измеряли с помощью коммерчески доступного радиоиммуноанализа (5), ранее подтвержденного для использования у кошек [11] . Анализ проводили в соответствии с инструкциями изготовителя с половиной объема плазмы ЭДТА и реагентами, рекомендованными для фазы генерации ангиотензина-I, за исключением того, что инкубацию образцов при 37 ° С проводили инкубатором, а не водяной баней. Половину рекомендованных объемов использовали для уменьшения количества плазмы, необходимой для проведения анализа. Концентрацию альдостерона в плазме измеряли с помощью коммерчески доступного радиоиммуноанализа (6) в соответствии с инструкциями производителя. Этот анализ также был ранее проверен для использования у кошек [16].
Статистический анализ
Статистический анализ выполнялся с помощью компьютеризированного статистического программного пакета. Результаты были представлены как медианы [25, 75-й процентиль], а статистическая значимость была определена как P ≤ 0.05, если только в противном случае указано. Для целей статистического анализа любому измерению ренина в плазме ≤0,05 нг/мл/ч было назначено значение 0,05 нг/мл/ч. Любую концентрацию альдостерона в плазме ≤11 пг / мл (самый низкий контрольный показатель обнаружения) была назначена на 11 пг/мл. Тест Крюскала-Уоллиса использовался для сравнения клинико-патологических переменных, включая концентрацию ренина и альдостерона среди групп (HT-Pre , HT-Post и NT) в начале исследования (время диагностики гипертиреоза). У-тест Mann-Whitney использовался для сопоставления пар в группах для выявления существенных различий. Коррекция Бонферрони применялась для коррекции множественных сравнений, поэтому статистическая значимость была определена как P<0.017. Эффект лечения оценивали по критерию рангов Вилкоксона для каждой группы. Точный тест Фишера использовался для сравнения доли животных, получавших тиреоидэктомию и антитиреоидный препарат между группами HT-Post и NT. Корреляции между клинико-патологическими переменными на исходном уровне были оценены коэффициентом корреляции Спирмена.
Результаты
Девяносто девять гипертиреоидных кошек имели право на включение в исследование. Все кошки не были азотемичными в начале исследования. Двадцать две кошки были гипертензивными во время диагностики гипертиреоза (группа HT-Pre), девять из которых имели гипертоническую ретинопатию. Двадцать четыре кошки развивали гипертензию в течение 6-месячного периода наблюдения после документации эутиреоза (группа HT-Post). В группе HT-Post 6 кошек (27%) лечились тиреоидэктомией, а 16 кошек (73%) получали антитиреоидные препараты. Тридцать шесть кошек в группе NT наблюдались в течение 6 месяцев после установления эутиреоза, из которых 20 кошек (56%) были обработаны тиреоидэктомией, а 16 кошек (44%) лечились антитиреоидным препаратом. Не было существенной разницы в отношении доли кошек, получавших тиреоидэктомию и антитиреоидные препараты между группами HT-Post и NT (P =0.267). Семь из 24 (29%) кошек в группе HT-Post также развили азотемию в течение 240 дней после установления эутиреоза, а 3 из 53 (6%) нормотензивных кошек развили азотемию в течение 240 дней после установления эутиреоза. Четыре из 24 кошек (17%) в группе HT-Post имели низкий уовень общего T4 в плазме в момент времени после лечения, а 7 из 53 (13%) нормотензивных кошек имели низкий уровень общего T4 в плазме в момент времени после лечения; однако в этих случаях не было обнаружено одновременных концентраций тиреотропных гормонов, чтобы подтвердить наличие ятрогенного гипотиреоза.
Кошки, которые были гипертензивными во время диагностики гипертиреоза, были значительно старше кошек, которые оставались нормотензивным в послеоперационном периоде (табл. 1, Р <0,001); однако не было существенной разницы в возрасте между другими группами. Возраст пятерых кошек (1 гипертония при постановке диагноза, 1 гипертоническая посттерапия и 3 нормотензивные) были неизвестны. Существовали также значительные различия в САД среди всех 3 групп в начале исследования (таблица 1, P <0.017 для сравнения среди всех групп). Других существенных различий в клинико-патологических переменных на исходном уровне среди 3 групп не было (таблица 1).
Таблица 1. Выбранные клинико-патологические переменные во время диагностики гипертиреоза у кошек, которые являются гипертензивными во время диагностики гипертиреоза (группа HT-Pre), кошек, у которых развивается гипертензия в течение 6 месяцев после начала лечения (группа HT-Post) и кошек которые остаются нормотензивными в течение 6-месячного периода после установления эутиреоза (группа NT).
Тест Kruskal-Wallis использовался для сравнения трех групп в исходных условиях для каждой переменной. Достоверность - значение.
| Показатель | Группа HT-Pre Медиана [25ый, 75ый пецентиль] | n | Группа HT-Post Медиана [25ый, 75ый пецентиль] | n | Группа NT Медиана [25ый, 75ый пецентиль] | n | Достов. |
| Возраст (годы) | 16.5 [15.0, 17.7]a | 21 | 15.0 [13.1, 17.0]ab | 23 | 13.8 [12.0, 15.0]b | 50 | <0.001 |
| Систолическое кровяное давление (mmHg) | 183.0 [176.2, 205.4]a | 22 | 159.0 [152.9, 173.5]b | 24 | 148.8 [131.8, 160.8]c | 53 | <0.001 |
| Концентрация общего Т4 в плазме (nmol/L) | 150.5 [100.4, 197.5] | 22 | 130.0 [92.3, 170.8] | 24 | 113.0 [71.3, 176.0] | 53 | 0.26 |
| Концентрация креатинина в плазме (mg/dL) | 1.13 [0.97, 1.28] | 20 | 1.13 [0.88, 1.34] | 21 | 1.06 [0.96, 1.21] | 40 | 0.59 |
| Концентрация калия в плазме (mmol/L) | 4.05 [3.67, 4.30] | 20 | 4.00 [3.65, 4.10] | 21 | 3.85 [3.63, 4.18] | 40 | 0.58 |
| Концентрация натрия в плазме (mmol/L) | 154.9 [153.0, 155.9] | 20 | 153.7 [152.0, 155.0] | 21 | 154.4 [152.0, 155.6] | 40 | 0.38 |
Группы, несущие разные буквы в верхнем индексе, существенно отличались друг от друга (P <0.017).
Не было существенной разницы в плазменном уровне ренина среди 3 групп на исходном уровне (группа HT-Pre 1.50 [0,05, 2,37] нг/мл/ч, n = 9, группа HT-Post 0,66 [0,17, 2,31] нг/мл/ч , n = 19, NT группа 1.11 [0,57, 2,18] нг/мл/ч, n = 39; P = 0,44, фиг.1). плазменная концетрация ренина значительно снизилась после лечения гипертиреоза как у HT-Post (0,71 [0,17, 2,33] против 0,28 [0,07, 0,57] нг/мл/ч, n = 18, P = 0,006, фиг.2) и NT-групп (1,09 [0,53, 2,47] против 0,22 [0,05, 0,76] нг/мл/ч, n = 32, P <0,001, фиг. 2). Также не было существенной разницы в плазменной концентрации ренина после лечения гипертиреоза между группами HT-Post и NT (P = 0.57).
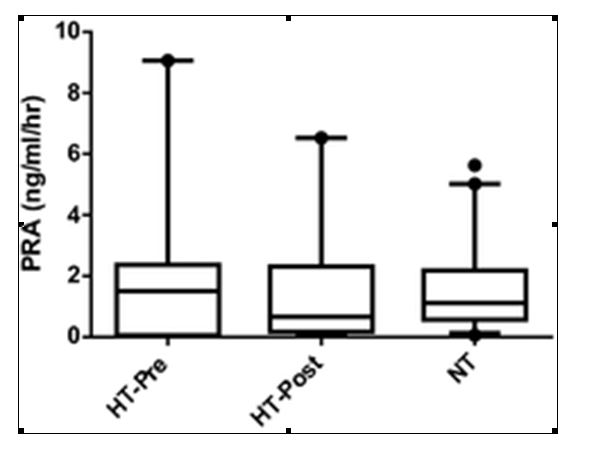
Рис 1. Диаграмма размаха, демонстрирующая активность ренина в плазме (PRA) у гипертироидных кошек на исходном уровне.
Девять кошек были гипертензивными во время диагностики гипертиреоза (группа HT-Pre), у 15 кошек развилась гипертензия в течение 6 месяцев лечения гипертиреоза (группа HT-Post) и 39 кошек оставались нормотензивными в течение 6-месячного периода после документирования эутиреоза (Группа NT). Тест Крускала Уоллиса показал, что между группами не было существенных различий (P =0.44).

Рис 2 Диаграмма размаха, демонстрирующие активность ренина в плазме (PRA) у пациентов с гипертиреозом до и после лечения гипертиреоза.
Тридцать четыре кошки оставались нормотензивными в течение 6-месячного периода после документации по эутиреозу (группа NT), а визит после лечения принимался в конце этого 6-месячного периода. Восемнадцать первоначально нормотензивных кошек развивали гипертензию в течение 6 месяцев лечения гипертиреоза (группа HT-Post). Посещение после лечения принимается за время диагностики гипертонии до начала любой антигипертензивной терапии. Плазменная концентрация ренина значительно снизилась после лечения как в группах HT-Post, так и в NT (P = 0.006 и P <0.001, соответственно). Неокрашенные прямоугольники представляют данные с точки времени предварительной обработки, тогда как прямоугольники с диагональным затенением представляют данные из точки времени после обработки.
Концентрация альдостерона в плазме не была существенно различной среди трех групп на исходном уровне (группа HT-Pre 72,2 [40,0, 145,6] пг/мл, n = 21, группа HT-Post 69,7 [43,3, 142,6] пг/мл, n = 24, NT-группа 109,0 [68,2, 184,6] пг/мл, n = 47, P = 0,10, рис. 3). Концентрация плазменного альдостерона значительно снизилась после лечения гипертиреоза в группе NT (114,4 [56,6, 204,1] против 59,5 [32,4, 98,2] пг/мл, n = 30, P <0,001, фиг.4), тогда как концентрация альдостерона в плазме не была достоверной после лечения гипертиреозом в группе HT-Post (61,2 [44,9, 124,0] против 58,4 [42,0, 97,7] пг/мл, n = 18, P = 0,59, рис.4). Не было существенной разницы в концентрации альдостерона в плазме между группами HT-Post и NT после лечения (P = 0.44).
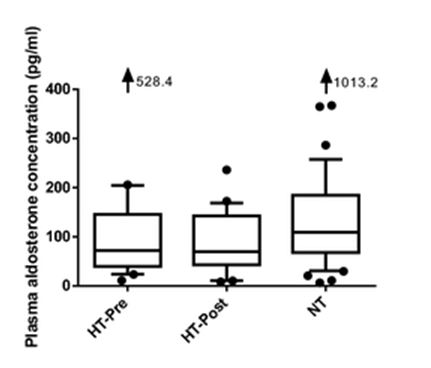
Рис 3 Диаграмма размаха, показывающие концентрацию альдостерона в плазме у гипертироидных кошек с гипертонией и без нее.
Двадцать одна кошка была гипертонической в момент диагноза гипертиреоза (группа HT-Pre), у 23 кошек развилась гипертензия в течение 6 месяцев лечения гипертиреоза (группа HT-Post) и 47 кошек оставались нормотензивными в течение 6-месячного периода после документации эутиреоза (группа NT). Тест Крускала Уоллиса показал отсутствие существенных различий между группами (P = 0.10).
Рис 4 Диаграмма размаха, показывающие концентрацию альдостерона в плазме у пациентов с гипертиреозом до и после лечения гипертиреоза.
Тридцать одна кошка остается нормотензивной в течение 6-месячного периода после документации эутиреоза (группа NT), а визит после лечения берется в конце этого 6-месячного периода. Восемнадцать первоначально нормотензивных кошек развивают гипертензию в течение 6 месяцев лечения гипертиреоза (группа HT-Post). Посещение после лечения принимается за время диагностики гипертонии до начала любой антигипертензивной терапии. Концентрация плазменного альдостерона значительно снизилась в группе NT (P <0,001); однако концентрация альдостерона в плазме существенно не изменилась после лечения в группе HT-Post (P = 0.59). Неокрашенные прямоугольники представляют данные с точки времени предварительной обработки, тогда как прямоугольники с диагональным затенением представляют данные из точки времени после обработки.
Препарат предварительной обработки альдостероном: ренин (ARR) существенно не отличался среди 3 групп на исходном уровне (группа HT-Pre 55,9 [35,2, 421,8], n = 8, группа HT-Post 94,3 [33,4, 252,4], n = 19, NT-группа 73.3 [36.4, 159.6], n = 33; P = .88). Также не было существенной разницы в ARR между группами HT-Post и NT после лечения (P = .89).
Концентрация плазменного натрия значительно снижалась при лечении (P = 0,017, таблица 2) в группе NT, хотя это изменение вряд ли будет клинически значимым. Напротив, концентрация натрия в плазме существенно не изменялась в группе HT-Post (P = 0,65, таблица 2). Четверо кошек в группе NT были слегка гипернатриемичными на исходном уровне. Не было существенной разницы в концентрации натрия в плазме между группами HT-Post и NT после лечения (P = 0,16).
Таблица 2. Избранные клинико-патологические изменения до и после лечения гипертиреоза у кошек.
Кошки были разделены на 2 группы; Группа NT - кошки оставались нормотензивными в течение 6-месячного периода после установления эутиреоза и в конце этого 6-месячного периода был взят как визит после лечения, группа HT-Post - кошки, у которых развивается гипертензия в течение 6 месяцев после начала лечения, дата диагноза гипертонии, принятая в качестве визита после лечения. Подписанный ранговый тест Wilcoxon использовался для сравнения выбранных переменных до и после лечения гипертиреоза. Достоверность. - значение
| Показатель | Перед лечением Median [25th, 75th percentiles] | После лечения Median [25th, 75th percentiles] | n | |
| Систолическое давление крови (mmHg) | ||||
| Группа HT-Post | 158.6 [151.7, 168.0] | 185.2 [179.7, 196.8] | 22 | 0.001 |
| Группа NT | 151.2 [133.5, 163.3] | 147.2 [135.6, 152.9] | 36 | 0.19 |
| Плазменная концентрация креатинина (mg/dL) | ||||
| Группа HT-Post | 1.09 [0.83, 1.38] | 1.79 [1.34, 2.90] | 15 | 0.002 |
| Группа NT | 1.07 [0.91, 1.28] | 1.50 [1.35, 1.94] | 21 | <0.001 |
| Плазменная концентрация калия (mmol/L) | ||||
| Группа HT-Post | 4.00 [3.70, 4.10] | 4.07 [3.90, 4.30] | 15 | 0.038 |
| Группа NT | 3.80 [3.65, 4.23] | 3.90 [3.60, 4.01] | 21 | 0.39 |
| Плазменная концентрация натрия (mmol/L) | ||||
| Группа HT-Post | 153.8 [152.0, 155.0] | 154.0 [150.0, 156.0] | 15 | 0.65 |
| Группа NT | 154.8 [151.4, 155.8] | 153.0 [150.5, 153.5] | 21 | 0.017 |
| Плазменный уровень общего Т4 (nmol/L) | ||||
| Группа HT-Post | 134.0 [101.9, 212.3] | 25.8 [4.8, 73.2] | 14 | 0.001 |
| Группа NT | 96.0 [67.8, 132.5] | 17.5 [6.8, 25.6] | 28 | <0.001 |
Концентрация калия в плазме значительно возрастала при лечении (P = 0,38, таблица 2) в группе HT-Post, хотя это изменение, вероятно, будет иметь минимальную клиническую значимость. Концентрация калия в плазме существенно не изменялась при лечении в группе NT (P = 0,39, таблица 2). Не было существенной разницы в концентрации калия в плазме между группами HT-Post и NT после лечения (P = 0,084).
Концентрация креатинина в плазме значительно возрастала при лечении как в группе HT-Post (P = 0,002, таблица 2), так и в группе NT (P <0,001, таблица 2). Не было существенной разницы в концентрации креатинина в плазме между группами HT-Post и NT после лечения (P = 0.34).
Концентрация в плазме общего Т4 значительно снижалась при лечении в обеих группах, как и ожидалось (табл. 2); однако 6 кошек в группе HT-Post не были хорошо контролируемы (общий T4 более 40 нмоль/л) в момент времени после лечения. Не было существенной разницы в систолическом давлении крови в момент времени после лечения между хорошо контролируемыми (n = 6) и плохо контролируемыми кошками (n = 18) в группе HT-Post (P = .53). Не было также существенных различий в концентрации Т4 в плазме между NT-группой и группой HT-Post после лечения (P = 0,13). Предварительная обработка плазменной активности ренина была значительно положительно коррелирована с концентрацией альдостерона в плазме перед обработкой (rs = 0,41, n = 60, P = 0,001) и концентрацией общего Т4 в плазме (rs = 0,456, n = 67, P <0,001). Предварительная обработка плазменной активности ренина также значительно отрицательно коррелировала с концентрацией креатинина в плазме (rs = -0,552, n = 53, P <0,001). Плазменная активность ренина не коррелирует с систолическим артериальным давлением (rs = -0,129, n = 67, P = 0,30). Концентрация плазменного альдостерона отрицательно коррелировала с концентрацией калия в плазме (rs = -0,289, n = 75, P = 0,012).
В группе NT наблюдалась слабая положительная корреляция между постлечебной плазменной активности ренина и концентрацией альдостерона в плазме после лечения (rs = 0,44, n = 31, P = 0,014) и концентрацией общего T4 в плазме после лечения (rs = 0,41, n = 27; P =. 036). Кроме того, была умеренная отрицательная корреляция между дозами плазменной активности ренина после лечения и пост-обработкой систолического кровянного давления (rs = -0,51, n = 33; P = 0,002) в группе NT, а постлечебная плазменная активность ренина имела тенденцию к значительной отрицательной связи с концентрацией креатинина после лечения плазмой (rs = -0,35, n = 28, P = 0,67). Последующая концентрация альдостерона в плазме в группе NT была достоверно, но слабо отрицательно коррелировалась с концентрацией калия после лечения (rs = -0,48, n = 30, P = 0,007). В группе HT-Post постлечебная плазменная активность ренина PRA была сильно положительно коррелирована с концентрацией общего T4 после обработки плазмой (rs = 0,74, n = 12, P = 0,006).
Обсуждение
Результаты этого исследования показывают, что существует повышенная регуляция ренин-ангиотензин-альдостероновой системы у лиц с гипертиреозом, и что это отменяется эффективным лечением гипертиреоза. Плазменная активность ренина значительно снизилась после лечения, что свидетельствует о том, что в гипертиреоидном состоянии было увеличено активность ренинна. Повышенная активность ренина в плазме возникает у пациентов с гипертиреозом [12]. Изменения концентрации активности ренина в плазме крови и плазменная концентрация альдостерона, которые возникают после лечения гипертиреоза, могут быть неизвестным побочным эффектом антитиреоидного препарата; однако эти изменения были продемонстрированы как у пациентов с гипертиреозом с медицинской, так и с хирургической точки зрения (данные не показаны), поэтому представляется более вероятным, что изменения в активности ренин-ангиотензин-альдостероновой системы после лечения являются следствием восстановления эутиреоза, а не эффекта лечения как такового.
Плазменная активность ренина гипертиреоидных кошек с гипертонической болезнью и без нее на исходном уровне не отличалась. В равной степени не было существенной разницы в плазменной активности ренина между гипертиреоидными кошками, которые оставались нормотензивными после лечения и кошками, у которых развилась гипертензия в течение 6 месяцев после лечения. В нормальных физиологических условиях было бы предположено, что группы HT-Pre и HT-Post с более высоким систолическим артериальным давлением на исходном уровне будут иметь более низкую активность ренина в плазме крови, чем нормотензивные кошки; однако, плазменная активность ренина не была существенно различной среди этих групп. Это может указывать на то, что активность ренина в плазме недостаточно высока в группах HT-Pre и HT-Post, так как мы ожидаем, что эти кошки (с более высоким САД) будут иметь более низкую плазменную активность ренина, чем группа NT. Сообщалось, что гипертензивные кошки с ХЗП имеют более высокие концентрации альдостерона в плазме (и более низкие показатели активности ренина в плазме), чем нормотензивные кошки с ХЗП [11] и также интересно отметить, что гипертензивные кошки с ХЗП имеют более низкие концентрации калия в плазме, чем нормотензивные кошки с ХЗП [3]. Известно, что первичный гиперальдостеронизм вызывает гипертонию у кошек [17]; однако концентрации альдостерона в плазме у гипертензивных кошек с ХЗП в предыдущих исследованиях [6, 11] значительно ниже, чем при первичном гиперальдостеронизме.
В этом исследовании концентрация альдостерона в плазме снижалась после лечения гипертиреоза у нормотензивных кошек (параллельные изменения в активности ренина в плазме), но не сильно изменилась у кошек, у которых развилась гипертония (несмотря на снижение активность ренина в плазме). Это могло бы значить, что это представляет собой основную невосприимчивую скорость секреции альдостерона у гипертензивных кошек, которая не связана с активностью ренина в плазме и представляет собой форму первичного гиперальдостеронизма; однако это не подтверждается результатами этого исследования, в котором концентрация альдостерона в плазме не отличалась у гипертензивных кошек, чем у нормотензивных кошек на исходном уровне. Концентрация альдостерона в плазме также не была существенно различной между группами NT и HT-Post после лечения гипертиреоза. Кроме того, ARR, который повышен у пациентов с первичным гиперальдостеронизмом [18], не был повышен у гипертонических гипертиреоидных кошек по сравнению с нормотензивными гипертиреоидными кошками в этом исследовании. Также может случиться так, что отсутствие изменений в концентрации альдостерона в плазме после лечения у кошек, у которых развилась гипертония, представляет собой базовый неиндуцируемый уровень альдостерона, который не реагирует на повышенную активность ренина при гипертиреозе. Секреция альдостерона надпочечниками может быть автономной по контролю ангиотензина II (и, возможно, калия и АКТГ) у кошек с гипертонией, и может быть связана с наличием адренокортикальной гиперплазии, о которой сообщалось у 95% гериатрических кошек в одном предварительном исследовании (8). Для проверки этой гипотезы потребуется динамическое тестирование функции надпочечников у кошек с гипертонией. Возможно, диссонанс между активностью ренина и концентрацией альдостерона в плазме у гипертонических кошек отражает дисфункцию ренин-ангиотензин-альдостероновой системы, которая, в свою очередь, может способствовать развитию гипертонии. Альтернативно, диссонанс между активностью ренина и концентрацией альдостерона в плазме у гипертонических гипертиреоидных кошек может не быть непосредственно вовлечен в патогенез гипертонии, но может быть связан с другим пока еще неопознанным патофизиологическим процессом, который приводит к развитию гипертензии. Кошки в группе HT-Post имели значительно более высокий базовый уровень САД, чем кошки в группе NT, хотя базовый САД для большинства кошек в обеих группах был ниже порога, который признан нашей клиник как связанный с поражением органов-мишеней (более 170 мм рт.ст.). Гипертироидные кошки, у которых развивается гипертензия после лечения, могут иметь основную предрасположенность к более высокому САД в гипертиреоидному состоянию, что может быть связано с очевидной дисфункцией ренин-ангиотензин-альдостероновой системы, наблюдавшейся в этой группе. Также может быть, что у кошек в группе HT-Post развивается гипертония после лечения гипертиреоза, потому что ренин-ангиотензин-альдостероновой системы не может адекватно реагировать на увеличение системного сосудистого сопротивления, которое возникает после восстановления эутиреоза. Результаты этого исследования показывают, что активация ренин-ангиотензин-альдостероновой системы у гипертироидных кошек не связана с развитием гипертензии и, таким образом, не поддерживает предположение, что активация ренин-ангиотензин-альдостероновой системы является основным патофизиологическим механизмом развития гипертензии у гипертироидных кошек. Тем не менее, активация ренин-ангиотензин-альдостероновой системы у гипертироидных кошек может быть вредной, поскольку она может способствовать сердечно-сосудистым повреждениям, почечной поражениям или и тому и другому [19] . Хотя 14% гипертиреоидных кошек, как сообщается, являются гипертензивными во время диагноза [2] , гипертония также известная как общий у кошек с ХЗП [3], который, как сообщается, также присутствует, по крайней мере, у 11% гипертиреоидных кошек [2].
Таким образом, возможно, что гипертензия у некоторых гипертироидных кошек может быть сопутствующим условием, а не прямым следствием самого гипертиреоза. Патогенез гипертонии у кошек с «сопутствующей» гипертензией может отличаться от патогенеза у кошек с гипертонической болезнью, вызванной гипертиреозом, что также могло повлиять на результаты этого исследования. В этом исследовании каждая кошка действовала как собственный контроль, так что изменения плазменной активности ренина и концентрации альдостерона в плазме, которые происходят до и после лечения гипертиреоза, могут быть идентифицированы. Выводы этого исследования будут усилены включением группы компараторов нормальных кошек, в которых измерялась активность ренин-ангиотензин-альдостероновой системы. Сообщалось, что контрольный диапазон для активности ренина у нормальных кошек составляет <0,05-1,8 нг / мл / ч [11] и 0,28-2,96 нг / мл / ч (полученный другим анализом активности ренина в плазме для этого исследования) [7]; однако диеты кошек, включенные в вышеупомянутые исследования, не были стандартизированы. Концентрация плазменной активности ренина и плазмы альдостерона зависит от диетических изменений у кошек [11], и поэтому вполне вероятно, что будут различия в индивидуальной концентрации ренина и альдостерона в плазме крови, которые обусловлены различиями в содержании натрия в рационе, что может смутить сравнение гипертонической и нормотензивной кошек. Таким образом, сравнение измеренных активности ренина и альдостерона у гипертироидных кошек с нормальной группой или контрольным диапазоном было бы неинформативным, если бы диеты не были стандартизированы. Это исследование не пыталось контролировать диету кошек, которые были включены в исследование, кроме исключения кошек, которые получали почечную лечебную диету , поскольку эти диеты имеют тенденцию к снижению содержания натрия, чем поддерживающие диеты. Хотя разницы в диетах, подаваемых каждой кошке, будет смешивать анализ в этом исследовании, диеты, подаваемые отдельным кошкам, вряд ли будут меняться с лечением таким образом, чтобы значительно повлиять на результаты. Однако следует ожидать, что лечение гипертиреоза может повлиять на аппетит отдельного кота, так что общее потребление натрия может уменьшиться. Результаты этого исследования можно было бы смутить за счет преувеличенного эффекта белого халата, о котором сообщалось у гипертироидных кошек, 9, поскольку это могло привести к тому, что некоторые нормотензивные гипертиреоидные кошки (без доказательств параллельной гипертонической ретинопатии) классифицируются как гипертензивные на момент постановки диагноза. В этом исследовании измерения артериального давления были получены в контролируемой среде опытным оператором, который, как сообщается, минимизирует влияние гипертензии белого халата на измерения артериального давления у гипертироидных кошек 9. Однако все же возможно, что некоторые из 13 кошек в группе HT-Pre без одновременной гипертензивной ретинопатии, возможно, не была действительно гипертонической, что могло бы смутить результаты поперечного анализа. Эффект лечения гипертиреоза на плазменную активность и концентрацию альдостерона в плазме в группе HT-Pre не был оценен в этом исследовании, поскольку результаты будут сбиты с помощью одновременного лечения гипертонии, что затрудняет интерпретацию данных. Кроме того, относительно небольшое количество образцов после лечения было доступно для кошек в этой группе, что ограничивало бы статистическую силу любого сравнения. плазменная активность ренина и концентрация альдостерона в плазме не измерялись в группе HT-Pre после лечения гипертонии и до начала лечения антитиреозом, поскольку оценка влияния лечения амлодипином на активность ренин-ангиотензин-альдостероновой системы не была целью этого исследования; однако в будущем исследования для изучения этого оправданы. В этом исследовании образцы хранили при -80 ° C до периодического анализа концентрации ренина и альдостерона, которая произошла через 11 лет после отбора проб; однако влияние длительного хранения на концентрацию ренина и альдостерона неизвестно. Хранение образцов при -80 ° C в течение 40 дней не приводило к значительному изменению активности ренина в одном из предыдущих исследований [11], однако эффект более длительного хранения не сообщался. В идеальном случае это было бы исследовано путем определения концентрации ренина и альдостерона в тех же образцах до и после длительного хранения в течение нескольких лет; однако для этого потребовалось бы долгосрочное исследование и было бы непрактичным. В этом исследовании не было достоверной корреляции между временем хранения и концентрацией альдостерона в плазме или плазме (данные не показаны), а время хранения не являлось значимым предиктором концентрации ренина или альдостерона после корректировки других клинокатологических переменных, которые были связаны с ренином или альдостероном в плазме в линейных регрессионных анализах (данные не показаны). Кроме того, как концентрация ренина, так и концентрация альдостерона в плазме снижались после лечения кошек в группе NT, хотя эти образцы хранили в течение примерно 6 месяцев меньше, чем исходные образцы. Если бы хранение образцов при -80 ° C приводило к значительному уменьшению измеренного ренина и альдостерона, то ожидалось, что концентрация ренина и концентрация альдостерона в плазме увеличится после лечения, чего не было в этом исследовании. Эти данные предполагают, что длительное хранение не оказывает существенного влияния на измеренную концентрацию ренина и альдостерона; однако необходимы дальнейшие исследования для изучения эффекта длительного хранения образцов при -80 ° С на ренин и альдостерон. Наконец, поскольку кошки, употребляющие почечные диеты, были исключены из исследования, относительно небольшое количество кошек, которые развивали азотемию после лечения гипертиреоза были включены в исследование. Несмотря на то, что ХЗП может присутствовать без азотемии, возможно, что были получены различные результаты, если бы было больше кошек, включенных в азотемический ХЗП, поскольку активность ренин-ангиотензин-альдостероновой системы увеличивается на более поздних стадиях ХЗП [11]. Необходимы дальнейшие исследования для оценки изменений в ренин-ангиотензин-альдостероновой системы (РААС) у гипертироидных кошек с азотемическим ХЗП, которые развивают гипертензию и которые остаются нормотензивными. В целом, это исследование не обнаружило доказательств увеличения активации ренин-ангиотензин-альдостероновой системы у гипертиреоидных кошек, которые являются гипертоническими на момент постановки диагноза, или те, у которых развивается гипертензия после лечения гипертиреоза по сравнению с нормотензивными гипертиреоидными кошками. У гипертиреоидных кошек, у которых развилась гипертензия после лечения, диссонанс между концентрацией альдостерона в плазме и ренином проявился в момент времени после лечения, что может указывать на дисфункцию ренин-ангиотензин-альдостероновой системы у этих кошек, что, в свою очередь, может способствовать развитию гипертонии.
ссылки
- Morrow LD, Adams VJ, Elliott J, Syme HM. Hypertension in hyperthyroid cats: Prevalence, incidence, and predictors of its development. J Vet Intern Med 2009;23:700 (abstract)
- Syme HM, Markwell PJ, Elliott J. Aldosterone and plasma renin activity in cats with hypertension and/or chronic renal failure. J Vet Intern Med 2002;16:354 (abstract).
- Jepson RE, Elliott J, Syme HM. The role of the renin-angiotensin-aldosterone system in the development of systemic hypertension in cats treated for hyperthyroidism. J Vet Intern Med 2005;19:424 (abstract).
- Idexx Laboratories, Wetherby, UK
- GammaCoat Plasma Renin Activity, Diasorin, MN
- Coat-a-Count, Siemens, Camberley, UK
- SPSS for Windows 17.0, SPSS Inc, Chicago, IL
- Keele SJ, Smith KC, Elliott J, Syme HM. Adrenocortical morphology in cats with chronic kidney disease and systemic hypertension. J Vet Intern Med 2009;23:1328 (abstract).
- Stepien R, Rapoport G, Henik R, et al. Effect of measurement method on blood pressure findings in cats before and after therapy for hyperthyroidism. J Vet Intern Med 2003; 17: 754 (abstract).
Литература
- Stiles J, Polzin D, Bistner S. The prevalence of retinopathy in cats with systemic hypertension and chronic renal failure or hyperthyroidism. J Am Anim Hosp Assoc 1994;26:647–651.
- Williams TL, Peak KJ, Brodbelt D, et al. Survival and the development of azotemia in hyperthyroid cats. J Vet Intern Med 2010;24:863–869.
- Syme HM, Barber PJ, Markwell PJ, Elliott J. Prevalence of systolic hypertension in cats with chronic renal failure at initial evaluation. J Am Vet Med Assoc 2002;220:1799–1804.
- Kobayashi DL, Peterson ME, Graves TK, et al. Hypertension in cats with chronic renal failure or hyperthyroidism. J Vet Intern Med 1990;4:58–62.
- Boag AK, Neiger R, Slater L, et al. Changes in the glomerular filtration rate of 27 cats with hyperthyroidism after treatment with radioactive iodine. Vet Rec 2007;161:711–715.
- Jensen J, Henik RA, Brownfield M, Armstrong J. Plasma renin activity and angiotensin I and aldosterone concentrations in cats with hypertension associated with chronic renal disease. Am J Vet Res 1997;58:535–540.
- Javadi S, Slingerland LI, van de Beek MG, et al. Plasma renin activity and plasma concentrations of aldosterone, cortisol, adrenocorticotropic hormone, and alpha-melanocyte-stimulating hormone in healthy cats. J Vet Intern Med2004;18:625–631.
- Levitan D, Massry SG, Romoff M, Campese VM. Plasma catecholamines and autonomic nervous system function in patients with early renal insufficiency and hypertension: Effect of clonidine. Nephron 1984;36:24–29.
- Hene RJ, Boer P, Koomans HA, Mees EJ. Plasma aldosterone concentrations in chronic renal disease. Kidney Int1982;21:98–101.
- Ishii M, Ikeda T, Takagi M, et al. Elevated plasma catecholamines in hypertensives with primary glomerular diseases. Hypertension 1983;5:545–551.
- Syme HM. Studies of the Epidemiology and Aetiology of Systemic Hypertension in the Cat. London: Department of Veterinary Basic Sciences, Royal Veterinary College; 2003. PhD Thesis.
- Resnick LM, Laragh JH. Plasma renin activity in syndromes of thyroid hormone excess and deficiency. Life Sci1982;30:585–586.
- Hauger-Klevene JH, Brown H, Zavaleta J. Plasma renin activity in hyper- and hypothyroidism: Effect of adrenergic blocking agents. J Clin Endocrinol Metab 1972;34:625–629.
- Shigematsu S, Iwasaki T, Aizawa T, et al. Plasma atrial natriuretic peptide, plasma renin activity and aldosterone during treatment of hyperthyroidism due to Graves' disease. Horm Metab Res 1989;21:514–518.
- Kahaly GJ, Dillmann WH. Thyroid hormone action in the heart. Endocr Rev 2005;26:704–728.
- Yu S, Morris JG. Plasma aldosterone concentration of cats. Vet J 1998;155:63–68.
- Djajadiningrat-Laanen SC, Galac S, Cammelbeeck SE, et al. Urinary aldosterone to creatinine ratio in cats before and after suppression with salt or fludrocortisone acetate. J Vet Intern Med 2008;22:1283–1288.
- Tiu SC, Choi CH, Shek CC, et al. The use of aldosterone-renin ratio as a diagnostic test for primary hyperaldosteronism and its test characteristics under different conditions of blood sampling. J Clin Endocrinol Metab2005;90:72–78.
- Briet M, Schiffrin EL. Aldosterone: Effects on the kidney and cardiovascular system. Nat Rev Nephrol 2010;6:261–273.
^Наверх









