Биологическая доступность лекарственных средств - Биодоступность фармакологических препаратов
Биодоступность - фармакокинетический параметр, характеризующий эффективность лекарственных препаратов путем определения той части лекарственного вещества, которая поступает в системный кровоток. При внутрисосудистом введении биодоступность лекарственного вещества составит 100%, при других путях (парентерально, ректальном и других) она значительно ниже и почти никогда не достигает 100%.
Биодоступность как метод исследования получила всеобщее признание во второй половине ХХ века, после открытия феномена терапевтической неэквивалентности лекарств с одинаковым составом, в идентичных лекарственных формах, но изготовленных на разных заводах. На сегодня биодоступность имеет государственную значимость при разработке, производстве и использовании лекарственных средств и как метод лежит в основе параметров определения биоэквивалентности по сути аналогичных лекарственных препаратов.
Существует несколько методов определения биодоступности лекарств, которые тесно связаны со скоростью и степенью всасывания (см. Абсорбция лекарств) и поступления действующих веществ в системный кровоток и их доставкой к месту лекарственного воздействия. Однако содержание лекарственного вещества (или активного метаболита) в крови и ее терапевтическая концентрация на месте действия могут значительно отличаться, в результате чего нужная концентрация может быть достигнута только после многократного введения лекарственного препарата.
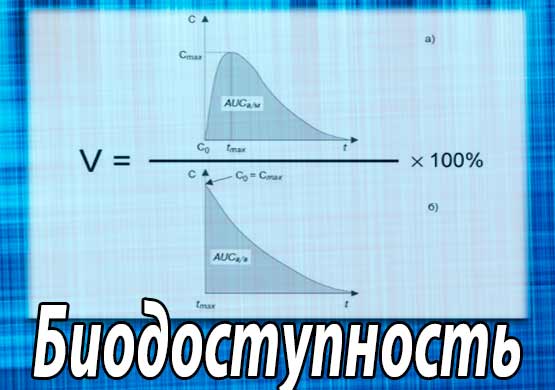
Однако количественная характеристика биодоступности для большинства лекарственных веществ может быть установлена только на основе их концентрации в крови (или в моче при экскреции), поскольку определение этого показателя непосредственно в месте действия технически, как правило, невозможно. Различают абсолютную и относительную биодоступность лекарств. Абсолютная биологическая доступность фармакологических средств определяется сравнением степени и скорости поступления субстанции исследуемого лекарственного препарата в системный кровоток (при условии внесистемного введения) со стандартом после его внутрисосудистого введения.
Относительная биологическая доступность определяется сравнением степени и скорости всасывания лекарственных средств (например, таблеток) с так называемым стандартом сравнения (например, капсул) при одинаковом или разных путях их введения (например, для таблеток и свечей) при условии, что они содержат одну и ту же активное вещество в одинаковом количестве.
Определение «относительная биодоступность» широко используется для подтверждения эквивалентности терапевтического действия по сути аналогичных препаратов референтном и сравнения терапевтической эффективности исследуемых препаратов.
В последнее время предложены математические методы количественной оценки биодоступности, которые включают следующие основные фармакокинетические показатели: функцию скорости всасывания a (t) и функцию экскреции e (t) лекарственного вещества, количество лекарственного вещества, поступившей в системный кровоток A (t) и экскретированный за этот же срок Ae (t). Этот процесс иллюстрируется общей схемой, которая, однако, не отражает других многочисленных процессов, происходящих в организме.
Общая схема основных процессов биологической доступности лекарственного вещества
Фактор F, который характеризует степень биодоступность лекарственного вещества при внесосудистом введении лекарств, вычисляют по следующим уравнениям:
- F = (Div ‧ АUС) / (D ‧ АUСiv)
- и F = (Div ‧ Ar (∞) / (D ‧ Ar, iv (∞),
где D - доза, характеризующий общий клиренс лекарственного вещества и является отношением Div к площади под кривой АUСiv в координатах концентрация - время.
По этому методу достаточно провести два полных фармакокинетических исследования (одно - после введения исследуемого препарата, второе - после внутрисосудистого введения) и определить площади под кривыми АUС и АUСiv или количества вещества, которое экскретировало с мочой Ar (∞) и Ar, iv (∞) , чтобы вычислить фактор F. Следовательно, интенсивность и продолжительность фармакологического действия лекарств зависят от их фармакокинетических характеристик (всасывание, распределение, биотрансформация, механизм экскреции, которые, в свою очередь, тесно связаны с понятием биодоступность. Например, степень и скорость всасывания являются неотъемлемыми характеристиками биологической доступности; распределение вещества и доставка к месту ее действия зависит от проникновения через многочисленные барьеры организма, интенсивность и скорость биотрансформации вещества определяется преимущественно эффектом ее первого прохождения через печень при внесосудистом пути введения, а срок действия - от показателя скорости экскреции из организма неизмененной вещества или активных его метаболитов).
Сложность качественной и количественной оценки биодоступности лекарственных препаратов связана с большим количеством факторов, влияющих на эти характеристики. Их разделяют на экзогенные (фармацевтические или технологические) и эндогенные (физиологические, генетические и др.). К экзогенных факторам, влияющих на биодоступность, относятся: физические свойства веществ (дисперсность, фильность, полиморфизм, оптические и другие характеристики), природа и количество вспомогательных веществ, входящих в состав лекарств, вид лекарственной формы, технология изготовления и некоторые другие (доза, путь, скорость введения лекарства, применение других лекарств, несоблюдение рекомендаций по лечебному питанию и т.п.), следует учитывать на этапах разработки, производства и применения лекарств. На биодоступность лекарств влияют также физиологические (пол, возраст, масса), генетические и этические показатели больного, наличие сопутствующих заболеваний и тому подобное. Сложность учета и соблюдения указанных факторов обусловливает необходимость проведения исследований по определению биологической доступности и биологической эквивалентности лекарств не на больных, а на здоровых людях, позволяет нивелировать полностью или частично влияние многих факторов во время эксперимента, получить более достоверные и воспроизводимые данные. Учет факторов, влияющих на биодоступность лекарств, позволяет оптимизировать режим их производства, приема и повысить эффективность фармакотерапии в целом.
Однако исследования биодоступности на живых организмах трудоемкие, дорогостоящие и не всегда могут применяться в обычных производственных условиях. Поэтому по рекомендациям ВОЗ в последние годы разрабатываются тесты биодоступности in vitro, с помощью которых можно прогнозировать потенциальную эффективность и характер действия лекарств и контролировать их качество при производстве. Одним из таких тестов является «Растворимость». Установлено, что скорость растворимости почти всех фармакотерапевтических групп лекарственных веществ отражает их приблизительную биодоступность. Одновременно проводятся исследования по сравнительной оценки методов корреляции исследований in vitro и in vivo, разрабатываются тесты «Растворимость» для индивидуальных лекарственных препаратов в форме мазей, суппозиториев; в фармакопеи или аучно-технической документации вводится тест «Высвобождение» (для пролонгированных лекарственных препаратов и трансдермальных систем) и другие.
Данная статья посвященна термину биодоступность (биологическая доступность) фармакологических препаратов.
^Наверх









