Аминокислоты (заменимые, незаменимые, виды)

Аминокислоты представляют собой производные различных видов карбоновых кислот, в которых в углеводородном радикале несколько или один атомов водорода замещены на аминогруппу. В зависимости от места расположения NH2-группы в биохимии выделяют β-, α-, γ- и другие типы соединений данного класса. В живых организмах данные соединения находятся в свободном состоянии или входят в состав протинов, пептидов, а также некоторых других биологически активных веществ. Существует более 300 аминокислот, которые входят в состав в различных животных, растений и микробиальных систем, но только 20 основных кодируются в ДНК и затем включаются в состав протеинов. Многие белки также содержат модифицированные остатки этих 20 аминокислот.
Аминокислоты, формируют первичную структуру белков, почти исключительно из α-типа указанных соединений, В которых аминогруппа и карбоксильная группа связаны с тем же атомом углерода (α-углеродный атом). В него также присоединен атом водорода и боковая цепь определенного строения (состава). Химическая природа последнего весьма вариабельна: от атома водорода к сложным циклическим субстанциям. Именно радикалы определяют функциональные и структурные особенности разных видов аминокислот, а α-атом Карбона в большинстве из основных 20 аминокислот (кроме глицина) является хиральным или центром асимметрии молекулы. Соответственно существует 2 конфигурации указанных веществ в пространстве, которые называются D (dextro, или правовращающая) и L (laevо, или левовращающая). Все аминокислоты в белках являются L-конфигурациями:
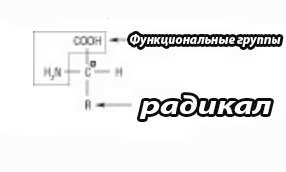
D-аминокислоты обычно не обнаруживают в составе белков, но они имеются в ряде антибиотиков и бактериальных клеточных стенках. Виды аминокислот, входящие в состав протеинов, имеют название протеиногенные. Среди них изолируют главные (это важнейшие 20) и редкие, которые преимущественно являются производными тех же 20 аминокислот. Например, 4-гидроксипролин и 5-гидроксилизин, содержащиеся в коллагене; ε-триметиллизин, обнаруженный в Са 2+ связывающих белках и др. Они образуются путем модификации главных аминокислот после их включения в состав соответствующего белка. Некоторые природные соединения данной группы, которые не обнаружены в белках, являются промежуточными метаболитами обмена веществ, например. L-орнитин и L-цитруллин - участники цикла мочевины в печени. Названия данных соединений строятся по заменяемой номенклатуре карбоновых кислот (например, Α-аминопропионовая кислота), но чаще применяются их тривиальные названия, например, глицин, аланин, серин и тому подобное. Существуют также трехбуквенные и однобуквенные обозначения аминокислот, например, глицин - гли, G; аланин - ала, А; лейцин - лей, L. Их используют для обозначения чередования аминокислот в пептидах или белках. Тривиальные названия довольно часто связаны с источником изоляции аминокислоты, или другим признакам. Например, глицин имеет сладкий вкус (от греческого слова - glycos - сладкий), серин входит в состав протеина шелка - фиброина (от латинского слова - serius - шелковистый), тирозин был впервые выделен из сыра (от греческого слова - tyros - сыр), аспарагиновая кислота - из ростков спаржи (от латинского слова – asparagus – спаржа) и др.
Аминокислоты классифицируются рядом способов в зависимости от признака, по которому происходит их разделение на группы. Принято три классификации видов аминокислот: структурная - по химическому строению радикала; электрохимическая – по кислотно-основным свойствам; биологическая (физиологическая) - по степени незаменимости аминокислоты для организма человека, животных, птиц. Алифатические (ациклические) соединения данной группы в зависимости от количества аминокислот и карбоксильных групп делятся на диаминомонокарбоновые, моноаминомонокарбоновые, моноаминодикарбоновые, диаминодикарбоновые. В зависимости от наличия специфической группы в радикале алифатические аминокислоты подразделяют на гидрокси-, серо-, амидосодержащие и др. Циклические аминокислоты разделяют на следующие виды: ароматические (карбоциклические) и гетероциклические, к которым относятся также иминокислоты. По электрохимическим (кислотно-основным) свойствам данные биологически активные вещества разделяют на три группы: кислотного характера - в боковом радикале имеютя дополнительные карбоксильные группы (моноаминодикарбоновые кислоты: глутаминовая и аспарагиновая) основного характера - диаминомонокарбоновые: лизин и аргинин, а также гистидин; нейтральные - остальные аминокислоты. Современная рациональная классификация видов аминокислот основывается на полярности радикалов, их способности к взаимодействию с водой при физиологических значениях водной среды (рН ≈7,0). Она содержит 4 группы указанных соединений: гидрофобные (неполярные), боковые радикалы которых не обладают сродством с водой. К ним относят валин, аланин, изолейцин, лейцин, пролин, метионин, фенилаланин, триптофан; гидрофильные (полярные) незаряженные - серин,глицин, треонин, тирозин, цистеин, аспарагин, глютамин; полярные негативно заряженные - глутаминовая и аспарагиновая кислоты, полярные позитивно заряженные - аргинин, лизин, гистидин.
По физиологическому (биологическому) значению химические субстанции рассматриваемого класса разделяют на 3 группы: незаменимые - не обладают способностью синтезироваться в организме из других химических субстанций, поэтому должны в обязательном порядке поступать с пищевыми продуктами (их для человека восемь: треонин, валин, метионин, изолейцин, фенилаланин, лейцин, лизин, триптофан), полузаменимые аминокислоты могут синтезироваться в организме, но в малом количестве, поэтому имеется частичная необходимость в их наличии в протеинах пищи (для человека таких три: тирозин, аргинин, гистидин), а также заменимые аминокислоты, которые продуцируются в организме в достаточной дозе из незаменимых аминокислот и других химических веществ. К ним относятся оставшиеся из 20 протеиногенных видов аминокислот. Свободные виды аминокислот - амфотерные соединения, содержащие как минимум две противоположные по функциональным свойствам группы (аминную и карбоксильную) и существуют в нескольких ионизированных состояниях с диссоциированной карбоксильной группой и протонизированной аминогруппой:
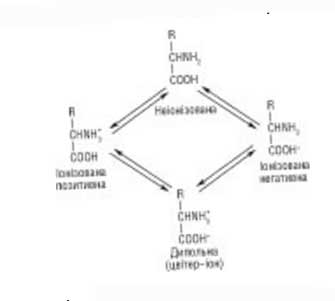
В нейтральном растворе и в кристаллах доминирующей формой аминокислот является цвитер-ион. В зависимости от рН среды они могут иметь кислые или основные свойства. В кислой среде указанные соединения несут положительный заряд, поскольку избыток протонов в среде ингибирует диссоциацию карбоксильных групп. В щелочной среде аминокислоты находятся в виде негативно заряженных ионов в результате диссоциации -СООН-группы. Состояние, при котором заряд аминокислоты равен нулю, имеет название -изоэлектрическое состояние. Значение рН среды, при котором аминокислоты достигают указанного состояния и не двигаются в электрическом поле, имеет название изоэлектрическая точка (ИЭТ) и обозначается РИ.
В соответствии со своей амфотерной природой рассматриваемые в данной статье вещества могут образовывать различные соли, реагируя как с основами, так и с кислотами. Например:
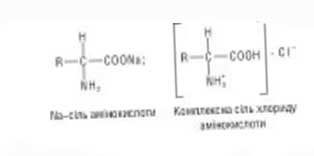
Кислотно-основные свойства аминокислот применяются при их идентификации и распределении с методами электрофореза и ионообменной хроматографии. Протеиногенные представители указанных веществ - это преимущественно бесцветные кристаллические вещества, многие из которых имеют хорошую растворимость в воде и плохую - в органических растворителях. Способность α-аминокислот растворяться в воде - важный фактор, который характеризует их биологические свойства. От растворимости в воде зависит всасывание аминокислот, их транспорт в организме, выделение с мочой и т. д. Содержание аминокислот в крови человека составляет около 0,5 г/л (от 10 до 100 мкмоль/л), учитывая и те, которые не обнаружены в белках. Всего в различных органах и тканях человека в метаболизме принимают участие более 80 вариантов указанных веществ. Концентрацию аминокислот в моче обычно определяют в мкмоль/г креатинина, который выводится в отношении постоянном количестве, в расчете на единицу массы тела в сутки. В наибольшем количестве с аминокислотами в моче присутствует глицин (400-2000 мкг/г креатинина). Очень важным свойством α- аминокислот является их функция вступать в реакцию поликонденсации при выделении молекулы воды за счет α-карбоксила одной аминокислоты и α-NH2-группы другой с образованием ковалентной амидной связи (-СО-NH-) между ними, который получил название пептидной. Образующиеся таким образом полиамиды имеют называние - пептиды. Полипептиды, которые характеризуются как белки отличаются от собственно пептидов не только количеством аминокислот, но и сложностью пространственной организации молекулы.
В практической гуманной и ветеринарной медицине широко применяют различные виды аминокислот (глицин, цистеин, метионин, гистидин, глютаминовую кислоту и др.); производные аминокислот, например, ацетилцистеин (муколитик); продукты обмена аминокислот - гамма-аминомасляной кислоты (аминалон, пантогам, гамалон - ноотропы), норадреналин, адреналин, дофамин и др. (вазотоники, кардиотоники); гидролизаты плазменных и тканевых протеинов, а также смеси индивидуальных аминокислот для парентерального питания и как плазмозамещающие средства (церебролизин, Аминовен инфант, Аминоплазмаль, Аминосол, Аминостерил N-гепа; желатиноль, альбумин, протамин сульфат, Дюфалайт и др.), а также препараты магниевой и калиевой соли аспарагиновой кислоты (аспаркам и панангин - калийсодержащие лекарственные средства или препараты калия)). Широко применяют препараты, в состав которых входят аминокислоты цистеин и тирозин: витайодурол, ангиотензинамид, тиреоидин и др.
^Наверх








