Симметричный диметиларгинин (СДМА тест) у кошек с гипертрофической кардиомиопатией и сахарным диабетом

Авторы
Langhorn R., Kieler I.N., Koch J., Christiansen L.B., Jessen L.R. Symmetric Dimethylarginine in Cats with Hypertrophic Cardiomyopathy and Diabetes Mellitus // J Vet Intern Med. 2018 Jan;32(1):57-63.
Абстракт
ЗАДНИЙ ПЛАН: Симметричный диметиларгинин (СДМА тест) все чаще используется в качестве маркера раннего хронического заболевания почек (CKD) у кошек, но мало известно о влиянии сопутствующих заболеваний на SDMA у этого вида.
ГИПОТЕЗА: Гипертрофическая кардиомиопатия (HCM) и сахарный диабет (DM), независимо от ХЗП, связаны с изменениями в SDMA сыворотки.
ЖИВОТНЫЕ: Девяносто четыре кошки (17 с ХЗП, 40 с HCM, 17 с DM и 20 здоровых контролей).
МЕТОДЫ: Исследование случай-контроль. Проведено клиническое обследование, эхокардиография, ЭКГ, артериальное давление, CBC, биохимия, тироксин и измерение SDMA. Анализ мочи проводился у контрольных и кошек с ХЗП и ДМ. Анализ дисперсии использовался для сравнения общих различий в данных, преобразованных в лог-преобразованный SDMA среди групп. Был применен случайный алгоритм фореста для изучения того, какие клинические и другие факторы влияют на SDMA сыворотки.
РЕЗУЛЬТАТЫ: Медиана (диапазон) сыворотки SDMA для почечной группы (положительный контроль) составляла 19 (10-93) мкг / дл, тогда как для контрольной группы (отрицательный контроль) она составляла 10 (5-15) мкг / дл. Для сердечной и диабетической групп сывороточный SDMA составлял 9 (4-24) мкг / дл и 7 (3-11) мкг / дл соответственно. Почечная группа имела значительно более высокие концентрации SDMA, а диабетическая группа значительно уменьшала концентрации тест СДМА по сравнению со всеми другими группами.
ВЫВОДЫ И КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ: Концентрация SDMA в сыворотке у кошек с HCM существенно не отличалась от концентрации здоровых контрольных кошек. Однако у кошек с ДМ были значительно более низкие концентрации SDMA, чем контрольные, результаты, которые требуют дальнейшего изучения, и их следует иметь в виду при оценке почечной функции кошек с этой эндокринопатией.
Ключевые слова: биомаркер, кардиология, животные-компаньоны, эндокринология
Опубликовано
Langhorn R., Kieler I.N., Koch J., Christiansen L.B., Jessen L.R. Symmetric Dimethylarginine in Cats with Hypertrophic Cardiomyopathy and Diabetes Mellitus // J Vet Intern Med. 2018 Jan;32(1):57-63.
Сокращения
- ANOVA дисперсионный анализ
- CKD хроническое заболевание почек
- DMd сахарный диабет
- GFR показатель клупочковой фильтрации
- HCM
- IRIS Международное общество почечных патологий
- IVС толщина интервентрикулярной перегородки в конце диастолы
- LVFWdleft толжина свободной стенки в диастолу,
- NO оксид азота
- RMSEroot-среднеквадратичная ошибка
- SAM систолическое переднее движение створки МК
- SDMA симметричный диметиларгинин
Хроническое заболевание почек (ХЗП) является наиболее распространенным метаболическим заболеванием у кошек [1]. Его распространенность увеличивается с возрастом, достигая более 80% у кошек старше 15 лет [2]. Хотя диагноз часто бывает прямым, когда кошки достигают азотемических стадий заболевания, раний диагноз является желательным, поскольку недавние исследования предполагают возможную выгоду от инициирования ренопротекторного пищевого лечения до этого этапа [3, 4].
Симметричный диметиларгинин (SDMA) является побочным продуктом нормального внутриклеточного белкового метаболизма, высвобождаемого после симметричного метилирования остатков аргинина и последующего гидролиза белка [5, 6]. Молекула почти полностью очищена клубочковой фильтрацией, где она свободно фильтруется из-за ее небольшого молекулярного размера и положительного заряда [5]. У кошек с ХЗП SDMA имеет обратную линейную зависимость с скоростью клубочковой фильтрации (СКФ) [7] и увеличивается, когда СКФ уменьшается примерно на 25%, со средним временем 17 месяцев до увеличения концентрации креатинина в сыворотке [8]. Следовательно, СДМА тест стал почечным маркером, представляющим значительный интерес в последние годы.
Хотя SDMA отражает функцию почек, он, как полагали, не влиял на нее или непосредственно не способствовал прогрессированию почечной болезни [9]. Однако в недавнем исследовании предположили, что симметричный диметиларгинин не может быть инертной молекулой в отношении почечной патологии [10]. Кроме того, SDMA по-видимому, играет важную роль в сосудистом гомеостазе, и, таким образом, до сих пор выясняются эффекты SDMA и на неренальные заболевания. Старшие кошки с ХЗП часто страдают от сопутствующих заболеваний, 2 из наиболее распространенных - гипертрофическая кардиомиопатия (HCM) и сахарный диабет (DM). Устранение влияния таких сопутствующих заболеваний на СДМА тест у кошек важно для подтверждения его надежности как почечного маркера.
В одном исследовании HCM у людей сообщалось об увеличении концентрации СДМА в сыворотке у пациентов с этим заболеванием [11]. Причина не была определена с уверенностью, но эффект может быть вызван эндотелиальной дисфункцией, из которой СДМА считается посредником [6]. Эндотелий сосудов высвобождает вазоактивные вещества такие как оксид азота (NO), которые помогают поддерживать целостность сосудов и регулируют его гомеостаз [12, 13]. Окись азота влияет на тонус сосудов, кровяное давление и региональный кровоток, а также оказывает противовоспалительное, антитромботическое и антиатеросклеротическое действие [6]. Симметричный диметиларгинин как полагают, уменьшает синтез NO путем конкурирования с его субстратом, аргинином, для поглощения клеток [14, 15]. Кроме того, эндотелиальная дисфункция также может быть опосредована провоспалительным эффектом тест СДМА на сосудистую стенку [10, 16]. Поскольку аномальная коронарная сосудистая сеть считается Важным фактором в патофизиологии HCM у кошек, как и у людей, является [11, 17] оценка SDMA у кошек с HCM.
У людей с DM интерпретация СДМА тест осложняется из-за частого развития диабетической нефропатии [18, 19, 20]. Однако у кошек, по-видимому, почечная недостаточность чаще встречается у лиц с диабетом, чем у контролей, совпадающих с возрастом [21]. Поэтому , возможное влияние DM на SDMA могло бы быть, по сути, более очевидным у кошек, чем у людей.
Цель нашего исследования состояла в том, чтобы установить, связаны ли HCM и DM, независимо от ХЗП, с изменениями в симметричном диметиларгинине сыворотки у кошек.
Материалы и методы
Кошек классифицировали по болезни как почечную группу (кошки с азотемическим почечным заболеванием, определяемые как концентрация креатинина в сыворотке> 140 мкмоль / л и удельный вес мочи <1,035), сердечная группа (кошки с HCM, определяемые как максимальная конечная диастолическая толщина межжелудочковой перегородка или каудальная свободная стенка левого желудочка> 5,5 мм в соответствии с обычным эхокардиографическим протоколом) [22], диабетическая группа (кошки с DM, определяемые как гипергликемия и глюкозурия при наличии соответствующих клинических признаков), и здоровая контрольная группа (кошки считаются здоровыми основанный на клиническом обследовании, эхокардиографии, ЭКГ и клинической патологии [ОКА, биохимия, анализ мочи и результаты тироксина сыворотки]). Все 4 группы кошек были включены ретроспективно из предыдущих проспективных исследований, проведенных авторами. Почечная группа была включена как положительный контроль, а здоровая контрольная группа - как отрицательный контроль для 2 групп исследованных кошек (сердечная и диабетическая группы). Каждое из проспективных исследований было одобрено этическим комитетом Департамента ветеринарных клинических наук, Копенгагенский университет, Дания, и было получено информированное согласие владельца на участие.
Все кошки были включены в службы внутренней медицины и кардиологии в Университетской больнице для животных-компаньонов, Копенгагенский университет, Дания. Для всех кошек было проведено клиническое обследование, проведена эхокардиография, ЭКГ, ПГС, биохимия и тироксин. Измерения артериального давления были выполнены для большинства кошек. Анализ мочи проводился для всех кошек в почечной, диабетической и контрольной группах.
Кошки были исключены из исследования, если им было менее 1 года. Для каждой из 3 групп болезней кошки с признаками сопутствующих заболеваний были исключены. Кошки с HCM были исключены, если были выявлены аномалии на CBC, биохимия, концентрация тироксина в сыворотке крови или артериальное давление. Поскольку моча и абдоминальные ультразвуковые исследования не были доступны для этой группы кошек, риск включения кошек со стадией 1 ХЗП в соответствии с руководящими принципами Международного общества по интересам почек (IRIS) не мог быть устранен, но все кошки с концентрацией креатинина в сыворотке> 140 мкмоль / л были исключены. Кошки с ДМ были исключены, если были выявлены аномалии на ОКА, биохимия (кроме тех, которые были связаны с DM), концентрация тироксина в сыворотке или эхокардиографии. Кошки с заболеванием почек были исключены, если были выявлены аномалии на ОКА, биохимия (отличные от тех, которые были связаны с ХЗП), концентрация тироксина в сыворотке или эхокардиографии.
Сыворотка для измерения симметричного диметиларгинина была получена из ведомственного биобанка. Сыворотку собирали в 4 мл пробирки для сепарации геля, оставляли сушить в течение 15 минут при комнатной температуре, центрифугировали при 2500 g в течение 5 минут, отделяли и хранили в криогенных сосудах при -80 ° C в течение 6 часов после сбора крови. Образцы хранились в течение максимум 6 лет до оттаивания и доставки в лаборатории IDEXX1 для анализа SDMA тест.
Статистический анализ
Данные анализировались коммерческим статистическим программным обеспечением. Нормальность данных оценивалась визуально гистограммами и qq-графиками. Если данные не были найдены нормально распределенными, они были преобразованы в нормальные и переоценены. Анализ дисперсии (ANOVA) с возрастом как кофактором использовался для сравнения общих различий в логарифмически измененных данных SDMA среди 4 групп; сердечной, диабетической, почечной и контрольной, соответственно. Последующий анализ двухстороннего ANOVA затем выполнялся Tukey Honest Significant Difference. Корреляция Спирмена использовалось для анализа степени корреляции между SDMA и переменными возрастом, массой тела, артериальным давлением (систолическим, диастолическим и средним артериальным давлением), гематокритом, концентрацией креатинина в сыворотке крови, концентрацией азота в мочевине и концентрацией тироксина. Значения Р были скорректированы с помощью ложных значений q-значения обнаружения и считались значимыми при <0,05.
Чтобы исследовать, какие факторы наиболее существенно повлияли на симметричный диметиларгинин, алгоритм случайного фореста был подготовлен путем 10-кратной перекрестной проверки с 80% данных и затем был проверен на оставшихся 20% данных [23]. Переменные, включенные в подготовку модели регрессии, включали те, для которых был проведен корреляционный анализ, а также групповой (сердечный, диабетический, почечный, контроль), порода, пол, стерилизация, а для сердечной группы - наличие или отсутствие застойной сердечной недостаточности или систолическое переднее движение передней створки митрального клапана (SAM). Значение Splitter было рассчитано на основе минимизации ошибки среднеквадратичного значения (RMSE), и были извлечены 10 наиболее важных функций из случайной модели леса.
Результаты
Исследовательская популяция была взята из 121 кошки. Двадцать семь кошек были исключены по вышеприведенным критериям, в результате чего окончательная группа исследователей из 94 кошек была распределена как 17 кошек в почечной группе (16 кошек с ХЗП, 1 кошка с ХЗП и обструктивным уретеролитиазом), 40 кошек в сердечной группе (все с HCM, 16 из которых имели SAM и 5 из которых были в сердечной недостаточности на основании клинических и эхокардиографических данных), 17 кошек в диабетической группе и 20 здоровых контрольных кошек. Демографические данные для каждой группы представлены в таблице 1. Измерения артериального давления были доступны для 15 кошек в почечной группе, всех кошек в группе сердца, 10 кошек в диабетической группе и 10 здоровых контролей.
Таблица 1 - Демографические данные включенных кошек
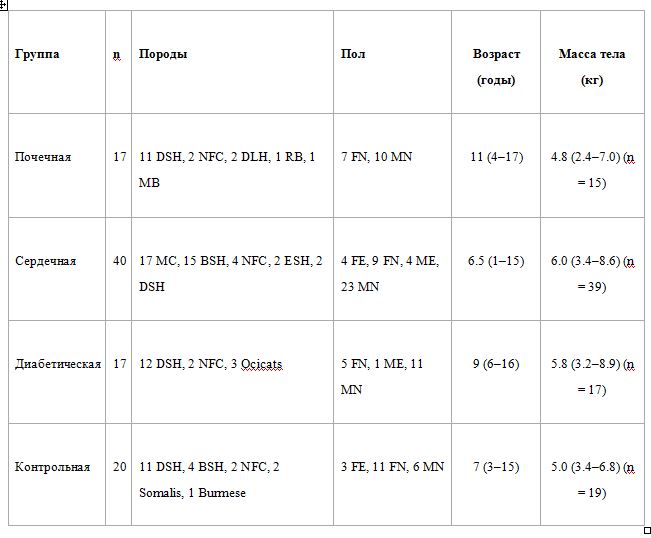
BSH, британская короткошерстная; DSH, домашняя короткошерстная; DLH, внутренний длинношерстный; ESH, экзотическая короткошерстная; МБ, смешанная порода; MC, мейн-кун; NFC, норвежская лесная кошка; РГ, русский синий; FE, женская целая; FN, женщины стерилизованы; ME, Мужской нормальный; MN, Мужской стерилизованный.
Медиана (диапазон) сывороточного симметричного диметиларгинина для почечной группы (положительный контроль) составляла 19 (10-93) мкг / дл, тогда как для контрольной группы (отрицательный контроль) она составляла 10 (5-15) мкг / дл. Для сердечной и диабетической групп сывороточный SDMA составлял 9 (4-24) мкг / дл и 7 (3-11) мкг / дл соответственно.
Почечная группа имела значительно более высокие концентрации симметричного диметиларгинина в сыворотке и креатинина по сравнению со всеми другими группами, тогда как диабетическая группа имела значительно более низкую концентрацию СДМА тест и креатинина в сыворотке по сравнению со всеми другими группами. Не было обнаружено существенной разницы между сердечной группой и контрольной группой для любой переменной (рис. 1 и 2) . Не было обнаружено существенного влияния на концентрацию симметричного диметиларгинина для любого возраста (P = 0,17) или взаимодействия между возрастом и группой (P = 0,42). Однако было обнаружено значительное влияние на концентрацию креатинина в сыворотке для взаимодействия между возрастом и группой (Р = 0,006), но не только для возраста (Р = 0,46).
Рисунок 1 - Концентрация SDMA в сыворотке контрольной группы, диабетической группы, кардиальной группы и почечной группы.
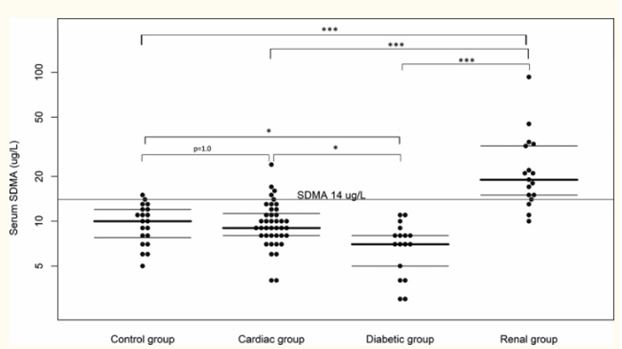
Медиана и межквартильные диапазоны показаны как горизонтальные линии. Статистическое значение между группами обозначается как P <0,05 = *, P <0,01 = ** или P <0,001 = ***.
Рисунок 2 Концентрация креатинина в сыворотке контрольной группы, диабетической группы, кардиальной группы и почечной группы
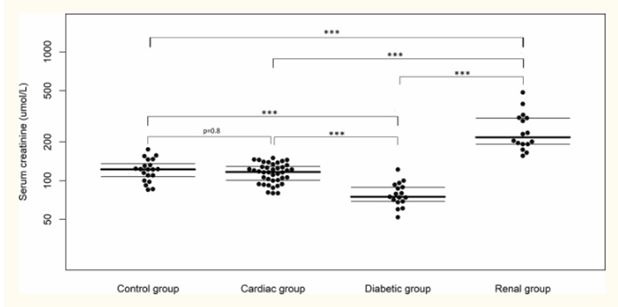
Медиана и межквартильные диапазоны показаны как горизонтальные линии. Статистическое значение между группами обозначается как P <0,05 = *, P <0,01 = ** или P <0,001 = ***.
Корреляционный анализ выявил значительную корреляцию только между концентрацией SDMA в сыворотке и концентрацией креатинина (R 2 = 0,53, Р <0,001).
Конечная случайная древовидная модель, применяемая к данным, была выбрана после 10-кратной перекрестной проверки путем образования 500 деревьев. Результаты модели были R 2 = 0,39 и RMSE = 1,96 при оценке случайным образом выбранных 20% данных, не используемых для обучения модели (тестовые данные). Предикторы с 10 наивысшими значениями переменной важности показаны на рисунке Рисунок 3.
Рисунок 3 - Предикторы теста SDMA в популяции из 94 кошек
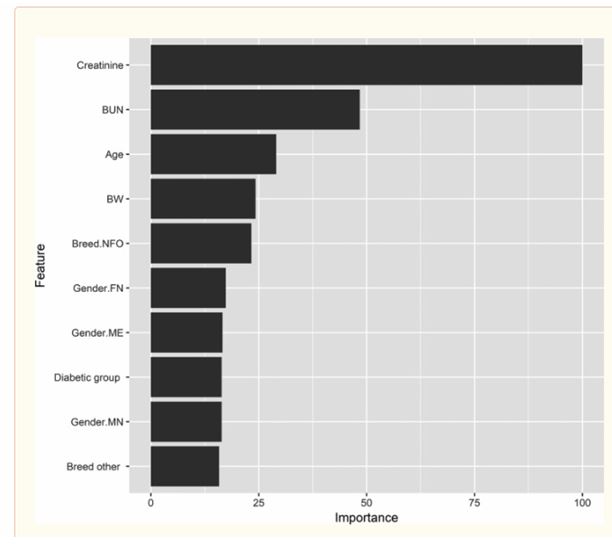
(контрольная группа, диабетическая группа, сердечная группа и группа почек) определялись с помощью алгоритма случайного леса, включающего возраст переменных, массу тела, артериальное давление (систолическое, диастолическое и среднее артериальное давление) , гематокрит, креатинин, азот мочевины крови, тироксин, группа, порода, пол, стерилизация, а для сердечной группы - наличие или отсутствие систолического переднего движения передней митральной листочки (SAM) и застойной сердечной недостаточности. Представлены предсказатели с 10 наивысшими показателями с переменным значением. BUN, азот мочевины крови; BW, масса тела; NFO, норвежская лесная кошка; FN, женщины стерилизованы; ME, Мужской нормальный; MN, Мужской стерилизуется.
Обсуждение
Наше исследование исследовало возможное влияние HCM и DM на сывороточные уровни симметричного диметиларгинина у кошек.
В отличие от того, что сообщалось у людей, 11 кошек с HCM в нашем исследовании не имели концентраций SDMA в сыворотке, значительно отличающихся от концентрации здорового контроля. Причина увеличения концентрации симметричного диметиларгинина в сыворотке у людей с HCM не была определена, но предположили, что она связана с напряжением сдвига, который увеличивает активность аргинин метилтрансферазы [24], фермента, ответственного за продукцию симметричного диметиларгинина и его аналога, асимметричного диметиларгинина. Обструктивная форма HCM, связанная с более высоким напряжением сдвига, связана с самыми высокими концентрациями SDMA у людей [11]. Сенсибилизирующее напряжение у кошек с HCM наиболее очевидно с частым появлением SAM, [25], который присутствовал у 16 из 40 кошек в нашем исследовании. Интересно, что SAM не было среди переменных, идентифицированных случайной моделью леса, как важных предикторов симметричного диметиларгинина сыворотки в нашем исследовании.
Хотя у большинства включенных кошек была скрытая болезнь сердца, у 5 кошек были клинические и эхокардиографические признаки застойной сердечной недостаточности во время презентации. Предыдущие исследования у людей и свиней показали связь между SDMA сыворотки и тяжести сердечной болезни [26, 27]. В нашем исследовании, однако, не было указаний на увеличение концентрации SDMA в сыворотке у кошек с сердечной недостаточностью. Фактически, эта небольшая группа кошек имела концентрацию SDMA в сыворотке в нижней половине диапазона сердечной группы, а HCM в целом, по-видимому, не влияли на симметричный диметиларгинин сыворотки. Тем не менее, для подтверждения этого открытия потребуется исследование, включающее большее количество кошек с более тяжелыми стадиями сердечных заболеваний и без побочных заболеваний почек.
Принимая во внимание влияние симметричного диметиларгинина на функцию эндотелия, описанную у людей, возможно, не удивительно, что данный биомаркер был связан с тяжести атеросклероза коронарных артерий [26, 28]. У людей с HCM были обнаружены признаки эндотелиальной дисфункции наряду с возможно, вызвано одновременным увеличением SDMA сыворотки [11]. Хотя аномальная коронарная сосудистая сеть также считается важной частью патофизиологии в HCM у кошек, [11, 17] атеросклероз необычен у этого вида [29]. Учитывая наши результаты, связь между сывороткой SDMA и эндотелиальная дисфункция могут быть не столь очевидны у кошек.
Другим важным нахождением нашего исследования было значительно более низкое содержание SDMA в сыворотке у кошек с DM по сравнению с контрольными. Он был отражен одновременным снижением концентрации креатинина в сыворотке в той же группе кошек. Предыдущие исследования не обнаружили, что кошки с сахарным имеют более низкие концентрации креатинина в сыворотке крови по сравнению со здоровыми кошками, но эти исследования включали DM-кошек с сопутствующим CKD, которые, возможно, скрывали результаты [21, 30]. Концентрация креатинина в сыворотке, как известно, уменьшалась с потерей мышц у пожилых животных, что может компенсировать увеличение, которое, как ожидается, произойдет с уменьшением СКФ. Однако СДМА тест не зависит от мышечного истощения, и было установлено, что влияние возраста на SDMA, ранее обнаруженное у более старых кошек, было связано с более старыми кошками, имеющими более низкую СКФ [31]. Соответственно, снижение концентрации SDMA в сыворотке диабетической группы не считается были связаны с истощением мышц, но считались связанными с самой болезнью, вывод, который был подтвержден случайным лесным анализом, в котором принадлежность к диабетической группе была одним из наиболее важных предикторов симметричного диметиларгинина. Тем не менее, вес также был предиктором в анализе, но кошки с ДМ были сопоставимы с весами контрольной группы (рис. 3, 3, таблица 1). Оптимально, конкретная мера мышечной массы, а не веса была бы полезно для оценки этих кошек, и, при отсутствии такой информации, причина снижения концентрации креатинина в сыворотке в этой группе не может быть окончательно определена.
У людей, в отличие от кошек, диабетическая нефропатия является основной причиной заболевания почек [18]. Более того, диабетические больные повышают риск развития сердечно-сосудистых заболеваний [32]. Более высокие концентрации SDMA в сыворотке, как ожидается, будут более частыми у людей с ДМ. Однако результаты противоречивы. В одном из исследований [19] обнаружено, что симметричный диметиларгинин является надежным маркером СКФ у детей с DM 1-го типа, тогда как в другом исследовании [20] обнаружены более низкие концентрации SDMA в сыворотке у людей с плохо контролируемым типом 2-го типа, чем при здоровом контроле. В соответствии с последним исследованием было показано, что люди с доказательствами резистентности к инсулину имеют более низкие концентрации SDMA в сыворотке [13,33]. Возможные механизмы включают повышенное поглощение клеток или усиление элиминации в ответ на гиперфильтрацию [33]. Кроме того, было высказано предположение, что печеночная метаболизм SDMA может быть повышенным у пациентов с резистентностью к инсулину [33, 34]. Инсулинорезистентность, как известно, является важным фактором развития DM у кошек [35], что является интересным фактом, потому что результаты нашего исследования отражают исследования людей с DM 2-го типа. Патофизиологически, вероятно, что гиперфильтрация и осмотический диурез являются наиболее важными факторами, приводящими к снижению концентрации симметричного диметиларгинина в сыворотке в ДМ, особенно у пациентов с плохо контролируемым ДМ. Из 17 кошек с DM, включенных в наше исследование, 6 были недавно диагностированы, а 4 все еще подвергались корректировке их лечения инсулином, что сделало бы гиперфильтрацию особенно вероятной в диабетической группе. Кроме того, 1 кошка была исключена из исследования из-за сопутствующего ХЗП и ДМ. Интересно, что у этой кошки была нормальная концентрация SDMA в сыворотке, несмотря на CKD, что, возможно, могло быть связано с одновременным DM. Соответственно, хотя эти данные должны быть подтверждены будущими проспективными исследованиями, симметричный диметиларгинин может быть менее ценным как тест на раннее ХЗП у кошек с ДМ.
Интересно отметить, что хотя почечная группа была включена в качестве положительного контроля нашего исследования, у 5 кошек с почечной недостаточностью действительно были концентрации SDMA в сыворотке в пределах контрольного диапазона. Причина этого обнаружения неизвестна, но служит напоминанием о том, что SDMA не обладает идеальной чувствительностью и всегда следует интерпретировать в свете другой клинической информации. Аналогично, у 1 здорового контрольного кота была умеренно повышенная концентрация SDMA в сыворотке. Мы решили не исключать этого кота из исследования, чтобы избежать смещения данных путем определения групп по переменной, по которой они были сопоставлены. Однако повторный анализ данных без этой кошки не изменил выводов. Ранняя болезнь почек у этой кошки является возможной и оптимально должна быть исследована с помощью измерения СКФ.
Основным ограничением нашего исследования является его ретроспективный дизайн. Однако оба случая и меры контроля были включены в предыдущие проспективные исследования, проведенные авторами, которые несли личную ответственность за систематический сбор данных от каждого животного. Отдельные группы болезней были довольно небольшими, особенно при оценке подмножества кошек с застойной сердечной недостаточностью, и для подтверждения наших результатов требуются более крупные исследования. Конкретным ограничением было отсутствие радиографического подтверждения застойной сердечной недостаточности для этой небольшой группы. Однако у всех кошек были значительно увеличенные левые предсердии и соответствующие клинические признаки, а у 4 из 5 кошек подтверждение отказа было достигнуто путем эхокардиографического обнаружения плевральной жидкости, перикардиальной жидкости или того и другого. Также возможно ограничение срока хранения образцов сыворотки. Образцы хранились при -80 ° C в течение максимум 6 лет, но, хотя долговременные исследования стабильности SDMA все еще необходимы, недавнее исследование на собаках показало, что SDMA не подвергается воздействию нескольких циклов замораживания-оттаивания и стабильной после 2 недель при комнатной температуре.36 Следовательно, симметричного диметиларгинина считается биомаркером высокой стабильности. Наконец, важным ограничением является отсутствие доступных данных мочи для сердечной группы. Хотя включенные кошки были неазотемическими, у некоторых, возможно, была болезнь 1 стадии IRIS. Более того, один кот получал лечение фуросемидом при презентации, что также могло повлиять на его концентрацию SMDA в сыворотке. Однако, поскольку сердечная группа имела концентрации SDMA в сыворотке, неотличимые от концентраций контрольной группы, эти возможные факторы считаются весьма важными.
В заключение мы не обнаружили влияния HCM на концентрацию симметричного диметиларгинина в сыворотке у кошек. Поэтому симметричный диметиларгинин может быть надежным маркером СКФ у кошек с HCM. Однако исследования, подтверждающие большее количество кошек с тяжелыми стадиями HCM, необходимы, чтобы подтвердить эти результаты. Кошки с сахарным диабетом имели значительно более низкую концентрацию SDMA тест в сыворотке, чем здоровый контроль, что требует дальнейшего изучения. Возможный эффект гиперфильтрации следует учитывать при оценке функции почек у кошек с ДМ.
Статья опубликована
Langhorn R., Kieler I.N., Koch J., Christiansen L.B., Jessen L.R. Symmetric Dimethylarginine in Cats with Hypertrophic Cardiomyopathy and Diabetes Mellitus // J Vet Intern Med. 2018 Jan;32(1):57-63.
Ссылки
- IDEXX Laboratories. Vet Med Labor GmbH, Mörikestrasse 28/3, D‐71636 Ludwigsburg, Germany
- “R” version 3.4.0. for Microsoft Windows. R Development Core Team (2008). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. ISBN 3‐900051‐07‐0, URL R-project.org
Литература
- Brown CA, Elliott J, Schmiedt CW, Brown SA. Chronic kidney disease in aged cats. Vet Pathol2016;53:309–326.
- Marino CL, Lascelles BDX, Vaden SL, et al. The prevalence and classification of chronic kidney disease in cats randomly selected within four age groups and in cats recruited for degenerative joint disease studies. J Feline Med Surg 2015;16:465–472.
- Hall JA, MacLeay J, Yerramilli M, et al. Positive impact of nutritional interventions on serum symmetric dimethylarginine and creatinine concentrations in client‐owned geriatric dogs. PLoS One 2016;11:1–14.
- Freeman LM, Lachaud MP, Matthews S, et al. Evaluation of weight loss over time in cats with chronic kidney disease. J Vet Intern Med 2016;30:1661–1666.
- Relford R, Robertson J, Clements C. Symmetric dimethylarginine: Improving the diagnosis and staging of chronic kidney disease in small animals. Vet Clin North Am ‐ Small Anim Pract 2016;46:941–960.
- Mangoni AA. The emerging role of symmetric dimethylarginine in vascular disease. Adv Clin Chem2009;48:73–94.
- Braff J, Obare E, Yerramilli M, et al. Relationship between serum symmetric dimethylarginine concentration and glomerular filtration rate in cats. J Vet Intern Med 2014;28:1699–1701.
- Hall JA, Yerramilli M, Obare E, et al. Comparison of serum concentrations of symmetric dimethylarginine and creatinine as kidney function biomarkers in cats with chronic kidney disease. J Vet Intern Med 2014;28:1676–1683.
- Veldink H, Faulhaber‐Walter R, Park J‐K, et al. Effects of chronic SDMA infusion on glomerular filtration rate, blood pressure, myocardial function and renal histology in C57BL6/J mice. Nephrol Dial Transplant 2013;28:1434–1439.
- Schepers E, Barreto DV, Liabeuf S, et al. Symmetric dimethylarginine as a proinflammatory agent in chronic kidney disease. Clin J Am Soc Nephrol 2011;6:2374–2383.
- Dimitrow PP, Undas A, Bober M, et al. Plasma biomarkers of endothelial dysfunction in patients with hypertrophic cardiomyopathy. Pharmacol Rep 2007;59:715–720.
- Jepson RE, Syme HM, Vallance C, Elliott J. Plasma asymmetric dimethylarginine, symmetric dimethylarginine, L‐Arginine, and nitrite/nitrate concentrations in cats with chronic kidney disease and hypertension. J Vet Intern Med 2008;22:317–324.
- Dimitroulas T, Hodson J, Sandoo A, et al. Symmetric dimethylarginine (SDMA) serum levels in rheumatoid arthritis: Correlations with insulin resistance and disease activity scores. Amino Acids2015;47:1995–2004.
- Closs EI, Basha FZ, Habermeier A, Förstermann U. Interference of L‐arginine analogues with L‐arginine transport mediated by the y+ carrier hCAT‐2B. Nitric Oxide Biol Chem 1997;1:65–73.
- Bogle RG, MacAllister RJ, Whitley GS, Vallance P. Induction of NG‐monomethyl‐L‐arginine uptake: A mechanism for differential inhibition of NO synthases? Am J Physiol 1995;269:C750–C756.
- Schepers E, Glorieux G, Dhondt A, et al. Role of symmetric dimethylarginine in vascular damage by increasing ROS via store‐operated calcium influx in monocytes. Nephrol Dial Transplant 2009;24:1429–1435.
- Liu SK, Roberts WC, Maron BJ. Comparison of morphologic findings in spontaneously occurring hypertrophic cardiomyopathy in humans, cats and dogs. Am J Cardiol 1993;72:944–951.
- Tuttle KR, Bakris GL, Bilous RW, et al. Diabetic kidney disease: A report from an ADA consensus conference. Diabetes Care 2014;37:2864–2883.
- Marcovecchio ML, Dalton RN, Turner C, et al. Symmetric dimethylarginine, an endogenous marker of glomerular filtration rate, and the risk for microalbuminuria in young people with type 1 diabetes. Arch Dis Child 2010;95:119–124.
- Can A, Bekpinar S, Gurdol F, et al. Dimethylarginines in patients with type 2 diabetes mellitus: Relation with the glycaemic control. Diabetes Res Clin Pract 2011;94:e61–e64.
- Zini E, Benali S, Coppola L, et al. Renal morphology in cats with diabetes mellitus. Vet Pathol2014;51:1143–1150.
- Langhorn R, Tarnow I, Willesen JL, et al. Cardiac Troponin I and T as prognostic markers in cats with hypertrophic cardiomyopathy. J Vet Intern Med 2014;28:1485–1491.
- Breiman L. Random forests. Mach Learn 2001;45:5–32.
- Osanai T, Saitoh M, Sasaki S, et al. Effect of shear stress on asymmetric dimethylarginine release from vascular endothelial cells. Hypertension 2003;42:985–990.
- Schober K, Todd A. Echocardiographic assessment of left ventricular geometry and the mitral valve apparatus in cats with hypertrophic cardiomyopathy. J Vet Cardiol 2010;12:1–16.
- Kiechl S, Lee T, Santer P, et al. Asymmetric and symmetric dimethylarginines are of similar predictive value for cardiovascular risk in the general population. Atherosclerosis 2009;205:261–265.
- Cirera S, Moesgaard SG, Zois NE, et al. Plasma proANP and SDMA and microRNAs are associated with chronic mitral regurgitation in a pig model. Endocr Connect 2013;2:161–171.
- Bode‐Boger SM. Symmetrical dimethylarginine: A new combined parameter for renal function and extent of coronary artery disease. J Am Soc Nephrol 2006;17:1128–1134.
- Kidd L, Stepien RL, Amrheiw DP. Clinical findings and coronary artery disease in dogs and cats with acute and subacute myocardial necrosis: 28 cases. J Am Anim Hosp Assoc 2015;36:199–208.
- Paepe D, Ghys LF, Smets P, et al. Routine kidney variables, glomerular filtration rate and urinary cystatin C in cats with diabetes mellitus, cats with chronic kidney disease and healthy cats. J Feline Med Surg 2015;17:880–888.
- Hall JA, Yerramilli M, Obare E, et al. Comparison of serum concentrations of symmetric dimethylarginine and creatinine as kidney function biomarkers in healthy geriatric cats fed reduced protein foods enriched with fish oil, L‐carnitine, and medium‐chain triglycerides. Vet J 2014;202:588–596.
- Pasterkamp G. Methods of accelerated atherosclerosis in diabetic patients. Heart 2013;99:743–749.
- Zsuga J, Török J, Magyar MT, et al. Dimethylarginines at the crossroad of insulin resistance and atherosclerosis. Metabolism 2007;56:394–399.
- Siroen MPC, Van Der Sijp JRM, Teerlink T, et al. The human liver clears both asymmetric and symmetric dimethylarginine. Hepatology 2005;41:559–565.
- Nelson RW, Reusch CE. Animal models of disease: Classification and etiology of diabetes in dogs and cats. J Endocrinol 2014;222:T1–T9.
- Nabity MB, Lees GE, Boggess MM, et al. Symmetric dimethylarginine assay validation, stability, and evaluation as a marker for the early detection of chronic kidney disease in dogs. J Vet Intern Med2015;29:1036–1044.
^Наверх









