Референтные интервалы и аллометрическое масштабирование двумерных эхокардиографических измерений у 150 здоровых кошек

Авторы
Karsten S., Stephanie S., Vedat Y. Reference intervals and allometric scaling of two-dimensional echocardiographic measurements in 150 healthy cats // J Vet Med Sci. 2017. -10;79(11):1764-1771.
Абстракт
Цель исследования состояла в том, чтобы оценить влияние массы тела (BW), породы и пола на двумерные (2D) эхокардиографические показатели, контрольные диапазоны и интервалы прогнозирования с использованием аллометрически масштабированных данных левого предсердия (LA) и левого желудочка (LV) и толщины стенок LV у здоровых кошек . Тип исследования - ретроспективная, наблюдательная и клиническая когорта. Было зарегистрировано 150 здоровых кошек и проанализированы 2D-эхокардиограммы. Диаметр LA, толщина стенки LV и размер LV определяли количественно с использованием трех разных изображений. Влияние BW, породы, пола, возраста и взаимодействия (BW * sex) на эхокардиографические переменные оценивали с использованием одномерной и многомерной регрессии и линейного смешанного модельного анализа. Определены стандартные (с использованием необработанных данных) и аллометрически масштабированные (Y = a × Mb) опорные интервалы и интервалы прогнозирования. У BW был значительный (P <0,05) независимый эффект на двумерные переменные, тогда как породы, пол и возраст - нет. Имеются клинически значимые различия между референтными интервалами с использованием среднего ± 2SD исходных данных и среднего и 95% интервалов предсказания аллометрически масштабированных переменных, наиболее заметных у более крупных (> 6 кг) и меньших (<3 кг) кошек. Было идентифицировано клинически значимое различие между толщиной межжелудочковой перегородки (IVS) и размером задней стенки LV (LVPW). В заключение следует отметить, что аллометрическое масштабирование и интервалы предсказания на основе BW на 95% должны быть предпочтительнее, чем обычные 2D-эхокардиографические контрольные интервалы у кошек, в частности у мелких и крупных кошек. Эти результаты особенно актуальны для скрининговых обследований для гипертрофической кардиомиопатии кошек.
Ключевые слова: кардиология, сердечно-сосудистая система, кошка, диагностика, эхокардиография
Диагноз кошачьей гипертрофической кардиомиопатии (HCM) был сложным из-за диагностических неопределенностей. Это наиболее проблематично в отношении программ скрининга, но также имеет отношение к другим популяциям кошек. Эхокардиография была основой диагностики болезней сердца у кошек. Однако, несмотря на десятилетия сбора данных и попытки определить фенотипическую нормальность, в том числе более 30 индивидуальных эхокардиографических исследований, ориентированных на референтные интервалы, опубликованные в период с 1979 по 2016 год, остается много споров относительно того, что определяет нормальный левый желудочек на эхокардиограмме у кошки. Использовались скорее произвольные диагностические обрезания, определяющие нормальную толщину стенки диастолического ЛЖ (левого желудочка) (5,0, 5,5 или 6,0 мм) [3,4,7,8,12,13,14,15,16,24,25 , 27, 30], хотя большинство ветеринарных кардиологов согласны с тем, что конечно-диастолическая толщина стенок LV у кошек среднего размера составляет около 4 мм [28]. В большинстве исследований эхокардиографических эталонных интервалов у кошек для сбора данных использовался М-режим [2, 3, 7, 8, 11, 14, 16, 17, 25, 27, 30, 34]. Однако HCM представляет собой гетерогенное заболевание с асимметричной гипертрофией ЛЖ, наиболее часто наблюдаемое [10, 12], что делает М-режим довольно плохим выбором, определяющим максимальную толщину стенки ЛЖ по сравнению с двумерным сегментным анализом [15].
Более того, вес тела (BW), по-видимому, важное соображение, когда линейные эхокардиографические меры используются для диагностических целей [5, 10, 21, 26], редко рассматривался. Применение фиксированных BW-независимых эталонных интервалов для всех кошек представляется проблематичным как ошибочное (ложноотрицательные меры у маленьких кошек и ложноположительные меры у крупных кошек), скорее всего, будет диагностировано [15]. Масштабирование (или нормализация) устраняет влияние размера тела на эхокардиографические меры, и могут применяться различные методы [5, 16, 21, 22, 29, 32, 35]. В то время как объемные эхокардиографические переменные линейно связаны с BW, индексы областей и линейные меры имеют нелинейное (экспоненциальное) отношение к BW, причем последнее только линейно относится к длине тела, а первое относится только линейно к площади поверхности тела [10, 29 ]. Поэтому, в то время как эффект BW можно удалить, просто разделив объемную меру на BW (объем пропорционален BW3 / 3, изометрическое масштабирование), индексы областей могут быть скорректированы только по BW, разделив меру площади на BW2 / 3 (тело площадь поверхности пропорциональна BW2 / 3, аллометрическое масштабирование), а линейные индексы могут быть нормированы только путем деления линейной меры на BW1 / 3 (длина тела пропорциональна BW1 / 3, аллометрическое масштабирование). Однако, основываясь на исследованиях у людей [26], лошадей [32], собак [5] и кошек [16, 33], показатель масштабирования (b) для одномерных мер может соответствующим образом отклоняться от его теоретического значения 0,33 ( BW1 / 3) среди видов и конкретных анатомических структур внутри одного вида, что требует изучения [5, 10, 16, 21, 26, 29, 33].
Таким образом, целью этого исследования было изучение независимых эффектов BW, породы и пола на линейные 2D-эхокардиографические переменные левого предсердия (LA) и размер LV и толщину стенки в когорте здоровых кошек. Мы предположили, что обычные эхокардиографические контрольные интервалы клинически значимо отличаются от аллометрически масштабированных эталонных интервалов и что BW, но не породы и пол, независимо влияют на эхокардиографические размеры LA и LV.
МАТЕРИАЛЫ И МЕТОДЫ
Животные
Медицинские записи Ветеринарного медицинского центра в Университете штата Огайо, Колумбус, штат Огайо, с мая 2003 года по октябрь 2014 года были найдены для кошек с диагнозом «Нормальные сердечно-сосудистые находки», которые подверглись трансторакальной эхокардиографии. Кошки были клинически здоровы при нормальном физическом осмотре. Они были в основном обследованы по просьбе заводчиков из-за присутствия мягкого сердечного ропота, душевного спокойствия клиента или как часть предварительного анестезирующего обследования. Критериями исключения были наличие сердечных шумов> 2/6, выявление любого заболевания, текущее введение лекарств с потенциальным воздействием на сердечно-сосудистую систему, обезвоживание и плохое качество изображения. Если кошки подверглись множественной эхокардиограмме, то был использован только последний экзамен, отвечающий стандартам включения. Эхокардиографические изображения проверялись и, следовательно, измерялись. Визуальный осмотр всех сердечных структур, включая сосочковые мышцы, был первым шагом к определению нормальности. Если есть сомнения, для подтверждающих доказательств потребовалась максимальная толщина стенки диастолической стенки менее 6 мм [12] с использованием 2D-изображений и трех стандартных изображений. Фокусное утолщение сегментной стенки ≥6 мм или резкие изменения толщины стенки более 50% в пределах одного сегмента, который составлял <6 мм, также считались аномальными, что приводило к исключению. Поскольку нормальный размер LA у кошек у конкретных кошек с низким и высоким BW плохо определен, часто используемое диагностическое исключение, измеренное в кранмально-каудальном измерении размера LA > 16 мм, указывающее увеличение LA, не использовалось в качестве независимого предиктора заболевания или ненормальность. Большинство здоровых кошек также были частью исследования о правильном размере сердца у недавно опубликованных кошек [35]; однако данные левого сердечной эхокардиографии еще не опубликованы.
Эхокардиография
Эхокардиографические исследования и количественная оценка изображения проводились, как сообщалось ранее [35]. Короче говоря, как только кошки были идентифицированы, все эхокардиограммы были повторно проанализированы. Изображения были количественно оценены одним наблюдателем (SS), а результаты представлены как среднее из трех-пяти измерений. В ситуациях диагностической неопределенности конкретные переменные не анализировались, а были отмечены как неполные. Все эхокардиограммы и измерения были впоследствии (в течение трех месяцев) рассмотрены главным исследователем (КС), оценены на достоверность и качество и были повторно измерены по мере необходимости. Трансторакальные эхокардиографические исследования проводились с использованием ультразвуковой системы (Vivid 7 Vantage ™ с версией программного обеспечения EchoPAc BT06, GE Medical Systems, Waukesha, WI, U.S.A.) с фазовыми преобразователями сектора на номинальных частотах 7 или 10 МГц. Эхокардиограммы выполняли сертифицированный кардиолог или резидент на тренировке под наблюдением кардиолога. Предварительная седация буторфанолом (0,15-0,20 мг / кг, IM, IVX Animal Health Inc., Майами, Флорида, США) была разрешена и не считалась нарушением критериев включения. Были получены стандартные эхокардиографические изображения, и данные о доплеровском эффекте 2D, M-моды, спектрального допплера и импульсных волновых тканях были зарегистрированы как недавно сообщалось [31]. Во время всего исследования на мониторе отображалась одиночная ЭКГ. Для измерения межжелудочковой перегородки (ИВС) использовалось расстояние от интерфейса ткани крови до границы ткани крови [20, 37]. Нежное движение назад и вперед с помощью трекбола эхокардиографической машины гарантировало идентификацию ложных сухожилий в интересующей области, которых избегали. Для задней стенки LV (LVPW) использовалось расстояние от границы ткани крови до границы ткани и перикарда [17].
Максимальный левый предсердный (Max LAD) краниально-каудальный размер [20, 37] измерялся из правой парастернальной длинноосевой4-камерной прекции (RPLax, View-1). Максимальный конечный диастолический размер стенок LV (LVPWd и IVSd) и размер LV (LVDd) измерялись с трех видов изображения: правая парастернальная длинная ось (RPLax, вид-1), правая парасиндальна короткая ось (RPSax, вид -2) и левые апикальные 4-камерные (LA4ch, View-3) виды [1]. Представления и целевые точки измерения, используемые во всех кошках, описаны на рисунке 1. Однако, поскольку местоположение максимальной конечной диастолической толщины стенки каждого сегмента может происходить в области, немного отличающейся от тех, которые показаны на рисунке из-за биологической изменчивости , рис.1 может служить только приближением, определяющим точки измерения. Изменчивость измерения оценивалась по повторному анализу восьми случайно выбранных исследований. Эти исследования были измерены три раза в течение одной недели одним наблюдателем для определения изменчивости измерения внутри наблюдателя и один раз вторым наблюдателем для оценки изменчивости измерений между наблюдателями. Вычислены коэффициенты вариации (CV) [35].
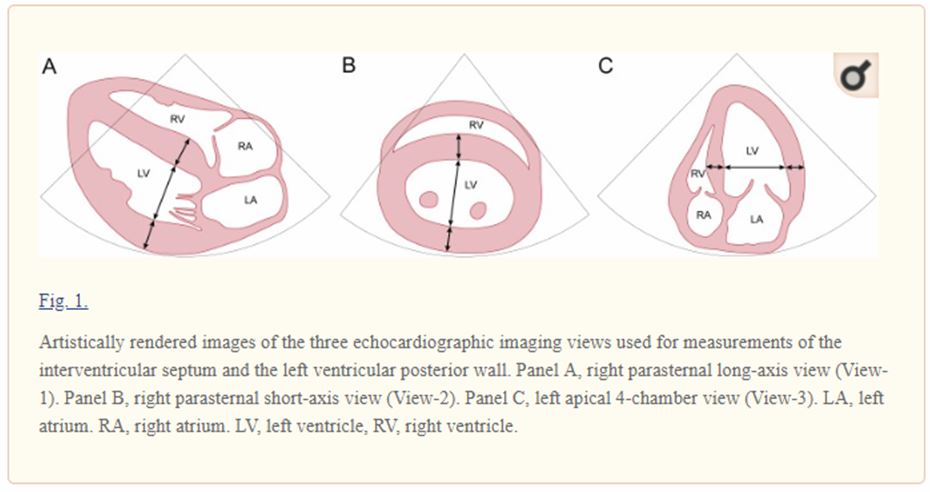
Анализ данных
Анализы проводились с использованием коммерчески доступного программного обеспечения (Systat версии 13.1, Systat, Chicago, IL, U.S.A. и Graph Pad Prism версии 6.07, Graph Pad, Сан-Диего, Калифорния, США). Нормальность данных оценивалась после визуального осмотра и с помощью теста Шапиро-Вилка. При необходимости применялось логарифмическое преобразование. В методе Winsorization были использованы адресные выбросы [9]. Непрерывные переменные сообщаются как среднее и стандартное отклонение (SD), так и категориальные данные как абсолютные (числовые) и частотные (процентные) данные.
Исходные интервалы определялись как обычным методом с использованием среднего ± 2 SD [23], так и метода аллометрического масштабирования с учетом влияния BW на линейные эхокардиографические меры [5, 21]. Для обоих среднее значение + 2 SD считалось верхним ссылочным пределом (URL), а среднее значение -2 SD - нижним контрольным пределом (LRL). Была проведена одномерная линейная регрессия, многомерный анализ (модель ANCOVA [GLM]) и линейная смешанная модельная регрессия для оценки влияния BW, возраста, пола и породы на переменные результатов. Чтобы исследовать потенциальное влияние колинейности между BW и полом, термин взаимодействия (BW * sex) был добавлен к общей линейной модели (полная модель: Y = BW + возраст + пол + породы + пол * BW). Для определения влияния BW на эхокардиографические измерения было использовано аллометрическое масштабирование. Вкратце, были получены константы и показатели из логарифмической формы аллометрического масштабирующего уравнения [log (Y) = log (a) + b × log (BW)], где a - постоянная пропорциональности, b - наклон (масштабирование экспонента), а Y - эхокардиографическая переменная, а BW - масса тела в кг. Интервал предсказания 95% (PI) затем определяли по следующей формуле:
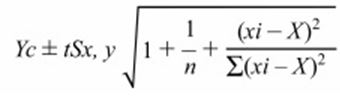
Yc - вычисленное значение Y для заданного значения Xi (BW в этом случае), t - t-статистика стьюдента для n-2 степеней свободы, n - размер выборки, Sx, y - стандартная ошибка оценки (среднеквадратичная ошибка), X - среднее значение, а xi - индивидуальное значение x [5, 33].
Для всех анализов значение Р ≤0,05 считалось значительным.
РЕЗУЛЬТАТЫ
Было идентифицировано в общей сложности 168 кошек, из которых 150 соответствовали критериям включения. Причинами исключения были неполные эхокардиографические данные и плохое качество изображения (n = 15), сердечный шум> 2/6 (n = 2) и текущее введение лекарств с потенциальными сердечно-сосудистыми эффектами (n = 1). Было 82 (55%) самок и 68 (45%) мужчин. Средний возраст составил 3,76 года (SD, 3,66), а средний возраст - два года (от трех месяцев до 16 лет). Семьдесят девять (52%) кошек были <2 годами, 37 (25%) кошек были от 2 до 6 лет, а 34 (23%) кошкам старше шести лет. Средний BW составлял 4,37 кг (SD, 1,28). BW из 24 (16%) кошек составляли <3 кг, 112 (75%) кошек были между 3 и 6 кг, а 14 (9%) кошек были выше 6 кг. Кошки были из 11 разных пород: 57 (38%) домашних кошек (домашние короткие волосы, домашние средние волосы и домашние кошки с длинными волосами), 51 (34%) бенгальские кошки, 14 кошек мейн-куна, 12 норвежских кошек Forrest, шесть турецких Ангора, четыре персидских, две гималайские, сфинкс и кошки Рагдолла. Десять (7%) кошек были седативными. В день исследования две кошки были на препарате профилактики дирофиляриоза. Оставшиеся 148 кошек не получали никаких лекарств. Ни у одной из кошек не было визуальных доказательств утолщения стенок ЛЖ или увеличения ЛА в любой форме изображения. Однако 26 (17%) имели максимальный размер LA> 16 мм, а шесть (4%) кошек имели, по меньшей мере, один сегмент стенки LV, измеренный> 6 мм. Кошки с максимальным размером LA> 16 мм составляли 12 кошек мейн-куна, 7 бенгальских кошек и 7 домашних кошек, 16 самец и 10 самцов и с более высоким BW (5,10 ± 1,10 против 4,48 ± 1,29 кг, P = 0,02 ). У двух кошек была минимальная регургитация митрального клапана, тогда как у 13 (9%) кошек была тривиальная трикуспидальная регургитация. У одной кошки были свидетельства систолического движения передней части хорды, и у пяти кошек были признаки мягкой динамической обструкции протока RV (Vmax <2,2 м / с). Среднее значение сердечного ритма ± SD составляло 184 ± 31 уд / мин. Средняя ± SD LV сокращающая фракция составляла 50% ± 10 (мин-макс, 30-78).
Результаты линейного регрессионного анализа логарифмически трансформированных эхокардиографических переменных, включая константы пропорциональности (а) и аллометрические показатели масштабирования (б), представлены в таблице 1. В таблице 2 приведены эхокардиографические эталонные значения после аллометрического преобразования данных. Обычные интервалы эталонных интервалов (среднее ± 2SD) и BW-отрегулированные интервалы для всех переменных с использованием аллометрического масштабирования [5, 33] и аллометрическое уравнение Y = a × Mb суммированы в таблице 3. IVSd необработанных данных и аллометрически масштабированных данных, сгруппированных в соответствии с до BW, был последовательно толще, чем LVPWd во всех изображениях (таблицы 2 и 3; 3; P <0,05). Более конкретно, разница между IVSd и LVPWd усредняла приблизительно 0,5 мм в View-1, 0,4 мм в View-2 и 0,3 мм в View-3 с IVSd> LVPWd. Учитывать только исходные данные; 75, 73 и 65% кошек имели более толстый IVSd по сравнению с LVPWd в Views-1, -2 и -3 соответственно.
Таблица 1. Результаты линейного регрессионного анализа логарифмически трансформированных эхокардиографических переменных и массы тела, включая константы пропорциональности (a) и аллометрические показатели масштабирования (b) от 150 здоровых контрольных кошек
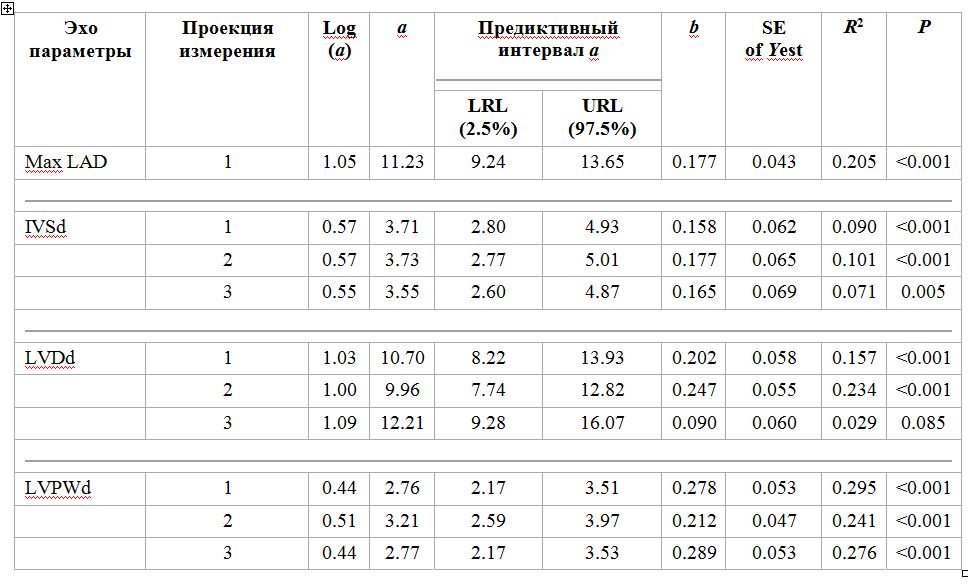
Для линейного регрессионного анализа использовалась логарифмическая форма аллометрического уравнения log (Y) = log (a) + b × log (BW). Y представляет собой эхокардиографическую переменную, а BW представляет собой массу тела. Регрессия дает константу b, которая представляет собой наклон линии регрессии и константу a, которая является антилогарифмом (log-1) y-перехвата линии регрессии. Переписанное уравнение можно документировать как аллометрическое уравнение Y = a × Mb. Интервалы прогнозирования (PI, доверительные интервалы 95%) для a были рассчитаны по формуле PI = log-1 [log (a) ± t × Sx, y] и значение (значение P) каждой индивидуальной регрессии. SE of Y est, стандартная ошибка оценки Y. t, критическое значение, основанное на t-статистике Стьюдента для n-2 степеней свободы и альфа 0,05. Sx, y - стандартная ошибка эхокардиографической оценки (Y), полученная по модели регрессии (среднеквадратичная ошибка). Вид изображения 1, правая парастернальная длинная ось. Вид изображения 2, правый парастернальный вид с короткой осью. Вид изображения 3, левый апикальный 4-камерный вид. Max LAD, максимальный кранио-каудальный размер левого предсердия. IVS, максимальная толщина межжелудочковой перегородки. LVD, максимальный внутренний размер левого желудочка. LVPW, максимальная толщина задней стенки левого желудочка. d, измеренный на концевой диастоле. Все переменные были определены из двумерных изображений.
Таблица 2. Эхокардиографические референсные значения (среднее ± стандартное отклонение и 95% эталонного интервала) левого предсердия и размерами левого желудочка после аллометрическим преобразования переменных у 150 здоровых контрольных кошек
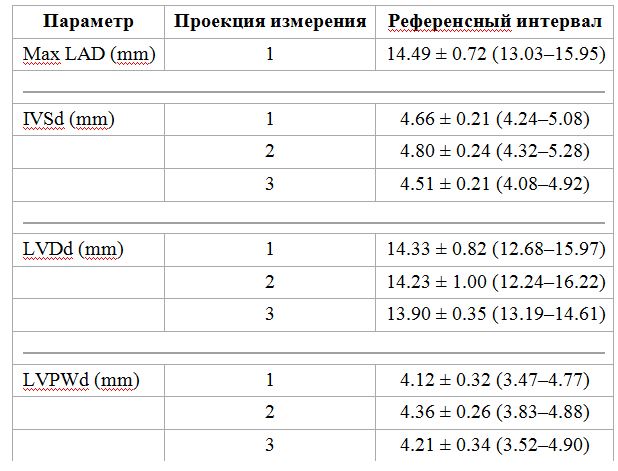
Для аллометрического масштабирования использовалось уравнение Y = a × Mb. См. Таблицу 1 для остальной части ключа.
Таблица 3. Эхокардиографические контрольные интервалы (среднее ± 2SD) и интервалы с аллометрически масштабированными данными [95% нижняя граница RI и 95% верхняя граница RI] левого предсердия и размеры левого желудочка у 150 здоровых контрольных кошек
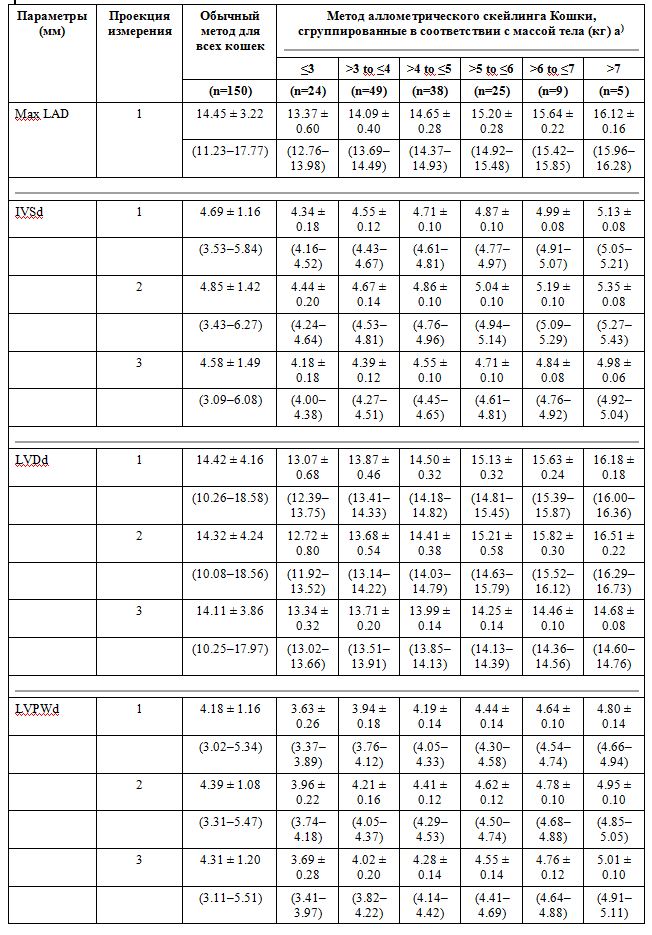
Параметры (мм) Проекция измерения Обычный метод для всех кошек Метод аллометрического скейлинга Кошки, сгруппированные в соответствии с массой тела (кг) a)
n, количество наблюдений. Для аллометрического масштабирования использовалось уравнение Y = a × Mb. См. Таблицу 1 для остальной части ключа. а) значения в круглых скобках под опорными интервалами составляют 95% верхние и 95% нижние границы.
Одномерный анализ выявил влияние BW на все непрерывные эхокардиографические переменные во всех изображениях (для Max LAD: r = 0,44, P <0,001; для IVSd: r от 0,27 до 0,29, все P <0,005; для LVPWd: r между 0,26 и 0,56, все P <0,002, а для LVDd: r между 0,21 и 0,40, все P <0,01). Возраст влияет на IVSd, измеренный в View-1 (P = 0,037). Пол влияет на все переменные (все P <0,05), за исключением LVDd в View-1 (P = 0,67). Порода оказала влияние на LVDd во всех трех изображениях (все P <0,018), при этом LVDd у бенгальских кошек была больше, чем у домашних кошек, используя необработанные данные. Не было различий в толщине стенок LV и Max LAD между бенгальскими кошками и домашними кошками (P> 0,20) для всех изображений.
Многомерный анализ, включающий BW, возраст, пол, породу и термин взаимодействия BW * sex в модели, показал последовательный эффект BW по всем переменным (все P <0,05). В модели не наблюдалось никакого эффекта (все P> 0.10) породы, возраста и пола (вне BW). Глядя конкретно на кошек с IVSd> LVPWd с использованием многомерной регрессии, наблюдался эффект увеличения BW в View-1 (P = 0,033). Интервалы прогнозирования с использованием аллометрически масштабированных данных и групп BW представлены в таблице 4. Для всех переменных значения BW и интервалы прогнозирования увеличивались с увеличением BW. Результаты регрессионного анализа с использованием логарифмически трансформированных эхокардиографических переменных, включая константы пропорциональности (а) и аллометрические показатели масштабирования (b), обнаруженные у домашних кошек и бенгалов, представлены в таблице 5. Различий между бенгальскими и домашними кошками для любой переменной в любой BW не было группа с почти одинаковыми значениями на основе BW (все P> 0.60).
Таблица 4 - Средства на основе массы тела и 95% интервалов предсказания размеров левого предсердия и левого желудочка и измерения толщины стенки левого желудочка, полученные из аллометрических параметров масштабирования у 150 здоровых контрольных кошек
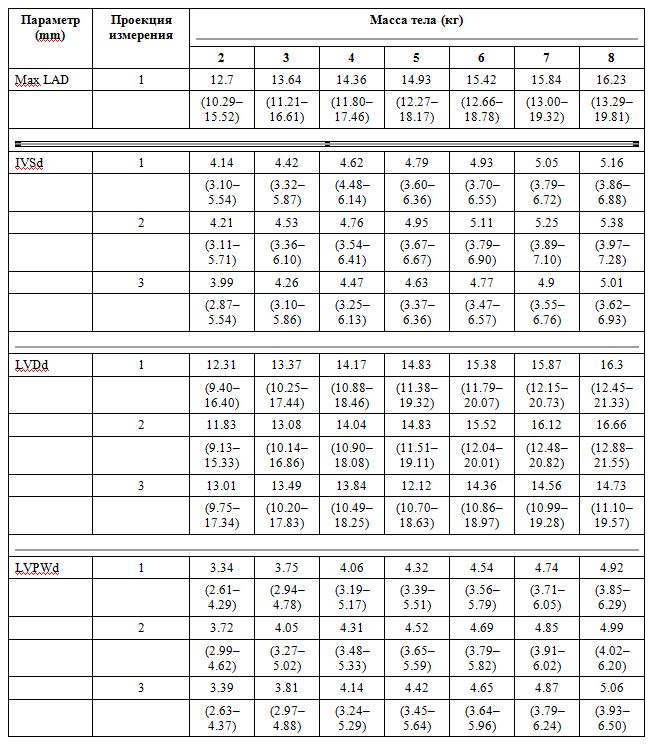
Таблица 5. Результаты линейного регрессионного анализа логарифмически трансформированных эхокардиографических переменных и массы тела, включая константы пропорциональности (а) и аллометрические показатели масштабирования (б) у 51 здоровой бенгальской кошки и 57 здоровых домашних кошек
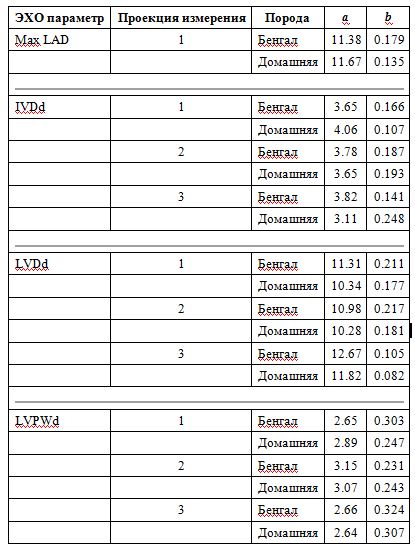
Для линейного регрессионного анализа использовалась логарифмическая форма аллометрического уравнения log (Y) = log (a) + b × log (BW). Y представляет собой эхокардиографическую переменную, а BW представляет собой массу тела. Регрессия дает константу b, которая представляет собой наклон линии регрессии и константу a, которая является антилогорифмом (log-1) y-перехвата линии регрессии. Переписанное уравнение можно документировать как аллометрическое уравнение Y = a × Mb. См. Таблицу 1 для остальной части ключа.
Изменчивость измерения внутри наблюдателя для всех переменных во всех представлениях изображений составляла от 1,7 до 6,5%, в среднем 3,9% для IVSd и 4,2% для LVPWd. Изменчивость измерения между наблюдателями составляла от 3,4 до 10,9%, в среднем 8,5% для IVSd и 10,9% для LVPWd.
ОБСУЖДЕНИЕ
Результаты этого исследования у 150 здоровых кошек демонстрируют, что (1) BW оказывает значительное и клинически значимое влияние на линейные 2D-эхокардиографические показатели LA и LV, (2) аллометрическое масштабирование устраняет влияние BW на эти измерения, (3) IVSd измеряет толще, чем LVPWd у большинства кошек, отказывающихся от использования фиксированного обрезания толщины стенки, и (4) нет независимого эффекта породы и пола на двумерные эхокардиографические переменные. Использование оценочных интервалов 95% на основе BW рекомендуется при оценке отдельных кошек, в частности при эхокардиографическом скрининговом обследовании.
По мнению авторов, только два предшествующих эхокардиографических исследования у здоровых кошек специально рассматривали влияние BW на левые сердечные эхокардиографические эталонные значения и применяли принципы аллометрического масштабирования для определения 95% интервалов прогнозирования [16, 33]. Связь между BW и линейными эхокардиографическими переменными хорошо известна [29] и сообщается в многочисленных исследованиях кошек [2, 7, 8, 11, 14, 17, 25, 30]. Однако из-за относительно небольшой BW кошек в пределах от примерно 2 до 10 кг воздействие BW на эхокардиографические показатели часто игнорировалось и считалось клинически неуместным [6, 28]. В большинстве исследований сообщалось о довольно низких коэффициентах определения (R2) между BW и линейных эхокардиографических измерениях <0,25 [3, 7, 14, 16, 25], что указывает на то, что факторы, отличные от BW, вносят вклад в изменчивость эхокардиографических переменных.
Снижение влияния размера тела на эхокардиографические размеры является целью масштабирования (или нормализации) и облегчает как правильное сравнение внутри когорты, так и среди когорт, а также точное построение эталонных стандартов нормальности [5, 29]. Хотя размер LA обычно нормализуется с использованием размера корня аорты (отношение LA: Ao) у кошек, масштабирование толщины стенки LV и размер LV в основном игнорируются. Используя различные виды изображений и 2D-эхокардиографию, мы могли бы продемонстрировать, что аллометрическое (нелинейное) масштабирование у кошек возможно с масштабированием показателей, соответствующим образом отклоняющимся от значений у людей [26], жеребят [32] и собак [5]. Аналогичные результаты были недавно опубликованы в исследованиях здоровых чистокровных кошек, использующих как 2D-визуализацию, так и М-режим для сбора данных [33] или только M-режим [16]. Последнее исследование [16] включало очень большую когорту кошек, разрешающую определение истинных эталонных интервалов для популяции.
Тем не менее, дизайн исследования в обоих исследованиях заметно различался, что вызывало непосредственное сравнение. В отличие от нашего исследования, были изучены только чистокровные кошки [16, 33], которые не представляют собой стандартную популяцию кошек, которую большинство ветеринаров изучают в ветеринарной практике. Возраст кошек был ниже [16], был использован только M-режим (в отличие от 2D) [16] с различиями между мерами M-моды и ожидаемыми 2D-измерениями [6], критерии включения относительно толщины стенки LV были («нормальность» была произвольно определена а-априори диастолической толщиной стенки Н <5 мм) [16], проводились исследования, и измерения, которые были относительно неконтролируемы разнообразной группой специализированных и неспециализированных экспертов в разных странах (по сравнению с одной центральное исследование со всеми изображениями, повторно измеренными стандартизованным образом), и метод измерения был другим (передний край к передней кромке [16] по сравнению с передней кромкой к задней кромке). В дополнение к гораздо меньшему числу кошек, эти различия могут объяснить более высокие предсказанные размеры и более широкие интервалы предсказания, найденные в нашем исследовании. Пол был значительным ковариатом толщины стенок LV в недавнем отчете о здоровых бенгальских котах [33]. Хотя его эффект был значительным и независимым от BW, он был довольно слабым и, вероятно, клинически неактуальным. Влияние пола на все 2D-измерения также наблюдалось в нашем исследовании с использованием одномерного анализа и с аналогичными результатами, о которых сообщалось в других публикациях [3, 8, 25]. Однако многомерное моделирование с использованием общей линейной модели не подтвердило таких результатов. Незначимость термина взаимодействия (BW * sex) в модели регрессии (Y = возраст + пол + породы + BW + пол * BW) продемонстрировала, что соотношение между (Y) и другими переменными в модели не отличается для самцов и самок. Коллинеарность между BW и полом, связанная с половым диморфизмом, является наиболее вероятной причиной различий между женщинами и мужчинами с использованием не скорректированных значений [17]. Поскольку аллометрическое масштабирование корректирует влияние BW, секс не нужно принимать во внимание, если используются аллометрические данные и 95% интервалов прогнозирования.
Сообщалось о вариациях в эхокардиографических переменных среди пород, и опубликованные справочные интервалы по отдельным публикациям [2, 3, 8, 13, 14, 17, 25, 33]. Однако до сих пор неясно, независим ли эффект породы от истинных физиологических различий или скорее связан с ассоциацией между породами и размером тела [2]. Наши результаты показывают, что порода не является независимым ковариатом за пределами BW, учитывая сравнение с отечественными кошками и бенгалами. Несмотря на значительные различия во всех двумерных переменных, количественно определяемые с использованием одномерного анализа, а также выявленные в других исследованиях [2, 3], эти различия исчезли после корректировки на BW, возраст и пол. Поэтому мы заключаем, что независимый эффект породы на 2D LA и LV эхокардиографические переменные, вероятно, менее значим, чем предполагалось ранее. Однако для обоснования этого утверждения необходимы исследования с участием большего количества пород с большим числом наблюдений.
Довольно удивительным результатом в этом исследовании было различие в средней толщине стенки между IVSd и LVPWd. IVSd была измерена толще LVPWd примерно у 75% кошек, что привело к средней разнице между сегментами от 0,3 до 0,5 мм в зависимости от вида изображения. Это различие клинически важно. Использование фиксированного отсечения для принятия диагностических решений потенциально может привести к неправильной классификации кошек. Тем не менее, кардиологи обычно не рассматривают дифференциальное обрезание при оценке кошек с помощью эхокардиографии. Хотя конкретно не обсуждалось, обнаружение толщины перегородки больше, чем свободная толщина стенки, было зарегистрировано ранее у кошек с разницей в 0,2-0,7 мм между IVSd и LVPWd в пользу IVSd [2, 3, 14, 24, 33]. В других исследованиях различий не было, хотя [8, 13, 17, 25]. Потенциальные причины расхождения между IVSd и LVPWd могут включать в себя истинные различия, систематическое измерение или ошибку записи, изображение артефакта в ближнем поле, загрязнение области, представляющей интерес, сосочковыми мышцами или хордальными сухожилиями правого желудочка и частое включение обнаруженных ложных сухожилий в выносящем тракте LV у нормальных кошек [15, 18, 19, 38]. Однако наличие ложных сухожилий представляется довольно проблематичным, когда используется эхокардиография М-режима, но менее вероятна при двумерных измерениях. Мы пытались идентифицировать и избегать ложных сухожилий или их вставок, иногда видимых как фокальные удары или пунктуальную гипергеогенность, хотя ошибка измерения не может быть исключена с уверенностью. Увеличение возраста может привести к утолщению очага дорзальной перегородки у кошек, но многомерный анализ не идентифицировал возраст как независимую переменную, способствующую разнице между IVSd и LVPWd.
Это исследование имеет ограничения. Количество кошек было относительно низким, что является актуальной проблемой, особенно при разделении кошек на группы BW для определения интервалов прогнозирования. Небольшое количество наблюдений влияет на интервалы между решениями и делает их клинически менее полезными. Для определения того, были ли кошки свободными от миокардиального заболевания или была скрытая HCM, не было найдено окончательного теста. Кошки были относительно молодыми с ограниченным возрастным диапазоном. Критерии включения и исключения любого исследования определяют выборку популяции и, таким образом, влияют на результаты с точки зрения их общей применимости. Таким образом, смещение выбора неизбежно и могло произойти в этом исследовании. Мы, возможно, отвергли нормальных кошек, устранили кошки с условным здоровьем («диагностические серые зоны») и включили кошек с скрытой HCM. Поэтому экстраполяция наших результатов на всю популяцию кошек, чтобы отделить «нормальных» кошек от «ненормальных» кошек, может быть неточной. Более того, физиологические варианты, не зависящие от BW и породы, включая анатомию папиллярных мышц, форму LV, а также распределение и вставку ложных сухожилий, которые не были специально рассмотрены в этом исследовании, возможно, привели к ошибочной классификации. Качество изображения было субоптимальным у некоторых кошек из-за ретроспективного использования ранее записанных данных.
Эхокардиографические изображения были получены различными наблюдателями с разным уровнем опыта и опыта. Показатели состояния тела [22] и частота сердечных сокращений [36] не были рассмотрены, но, как известно, влияют на двумерные эхокардиографические переменные у кошек. В заключение следует отметить, что интервалы прогнозирования на основе алометрического масштабирования и BW-95% должны быть предпочтительнее, чем обычные 2D-эхокардиографические контрольные интервалы в кошек, в частности у маленьких и больших кошек. Влияние пола и породы на эхокардиографические контрольные интервалы невелико и, следовательно, может быть проигнорировано. IVS и LVPW требуют разных контрольных диапазонов и интервалов прогнозирования для диагностической оценки. Эти результаты особенно актуальны для скрининговых обследований для гипертрофической кардиомиопатии кошек.
Статья опубликована
Karsten S., Stephanie S., Vedat Y. Reference intervals and allometric scaling of two-dimensional echocardiographic measurements in 150 healthy cats // J Vet Med Sci. 2017. -10;79(11):1764-1771.
Литература
- Boon J. A. 2011. Evaluation of size, function, and hemodynamics. pp. 153–156. In: Manual of Veterinary Echocardiography, 2nd ed. (Boon, J. ed), Wiley-Blackwell, Chichester.
- Chetboul V., Sampedrano C. C., Tissier R., Gouni V., Saponaro V., Nicolle A. P., Pouchelon J. L. 2006. Quantitative assessment of velocities of the annulus of the left atrioventricular valve and left ventricular free wall in healthy cats by use of two-dimensional color tissue Doppler imaging. Am. J. Vet. Res. 67: 250–258.
- Chetboul V., Petit A., Gouni V., Trehiou-Sechi E., Misbach C., Balouka D., Carlos Sampedrano C., Pouchelon J. L., Tissier R., Abitbol M. 2012. Prospective echocardiographic and tissue Doppler screening of a large Sphynx cat population: reference ranges, heart disease prevalence and genetic aspects. J. Vet. Cardiol. 14: 497–509.
- Christiansen L. B., Prats C., Hyttel P., Koch J. 2015. Ultrastructural myocardial changes in seven cats with spontaneous hypertrophic cardiomyopathy. J. Vet. Cardiol. 17 Suppl 1: S220–S232.
- Cornell C. C., Kittleson M. D., Della Torre P., Häggström J., Lombard C. W., Pedersen H. D., Vollmar A., Wey A. 2004. Allometric scaling of M-mode cardiac measurements in normal adult dogs. J. Vet. Intern. Med. 18: 311–321.
- DeMadron E., Bonagura J. D., Herring D. S. 1985. Two-dimensional echocardiography in the normal cat. Vet. Radiol. Ultrasound 26: 149–158.
- Domanjko Petrič A., Rishniw M., Thomas W. P. 2012. Two-dimensionally-guided M-mode and pulsed wave Doppler echocardiographic evaluation of the ventricles of apparently healthy cats. J. Vet. Cardiol. 14: 423–430.
- Drourr L., Lefbom B. K., Rosenthal S. L., Tyrrell W. D., Jr. 2005. Measurement of M-mode echocardiographic parameters in healthy adult Maine Coon cats. J. Am. Vet. Med. Assoc. 226: 734–737.
- Ette E. I., Onyiah L. C. 2002. Estimating inestimable standard errors in population pharmacokinetic studies: the bootstrap with Winsorization. Eur. J. Drug Metab. Pharmacokinet. 27: 213–224.
- Fox P. R. 2003. Hypertrophic cardiomyopathy. Clinical and pathologic correlates. J. Vet. Cardiol. 5: 39–45.
- Fox P. R., Bond B. R., Peterson M. E. 1985. Echocardiographic reference values in healthy cats sedated with ketamine hydrochloride. Am. J. Vet. Res. 46: 1479–1484.
- Fox P. R., Liu S. K., Maron B. J. 1995. Echocardiographic assessment of spontaneously occurring feline hypertrophic cardiomyopathy. An animal model of human disease. Circulation 92: 2645–2651.
- Granström S., Godiksen M. T., Christiansen M., Pipper C. B., Willesen J. T., Koch J. 2011. Prevalence of hypertrophic cardiomyopathy in a cohort of British Shorthair cats in Denmark. J. Vet. Intern. Med. 25: 866–871.
- Gundler S., Tidholm A., Häggström J. 2008. Prevalence of myocardial hypertrophy in a population of asymptomatic Swedish Maine coon cats. Acta Vet. Scand. 50: 22–27.
- Häggström J., Luis Fuentes V., Wess G. 2015. Screening for hypertrophic cardiomyopathy in cats. J. Vet. Cardiol. 17 Suppl 1: S134–S149.
- Häggström J., Andersson Å. O., Falk T., Nilsfors L., OIsson U., Kresken J. G., Höglund K., Rishniw M., Tidholm A., Ljungvall I. 2016. Effect of body weight on echocardiographic measurements in 19,866 pure-bred cats with or without heart disease. J. Vet. Intern. Med. 30: 1601–1611.
- Kayar A., Ozkan C., Iskefli O., Kaya A., Kozat S., Akgul Y., Gonul R., Or M. E. 2014. Measurement of M-mode echocardiographic parameters in healthy adult Van cats. Jpn. J. Vet. Res. 62: 5–15.
- Kervancioğlu M., Ozbağ D., Kervancioğlu P., Hatipoğlu E. S., Kilinç M., Yilmaz F., Deniz M. 2003. Echocardiographic and morphologic examination of left ventricular false tendons in human and animal hearts. Clin. Anat. 16: 389–395.
- Kimura Y., Karakama S., Kobayashi M., Machida N. 2016. Incidence, distribution and morphology of left ventricular false tendons in cat hearts. Anat. Histol. Embryol. 45: 490–493.
- Lang R. M., Badano L. P., Mor-Avi V., Afilalo J., Armstrong A., Ernande L., Flachskampf F. A., Foster E., Goldstein S. A., Kuznetsova T., Lancellotti P., Muraru D., Picard M. H., Rietzschel E. R., Rudski L., Spencer K. T., Tsang W., Voigt J. U. 2015. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J. Am. Soc. Echocardiogr. 28: 1–39.e14.
- Lindstedt S. L., Schaeffer P. J. 2002. Use of allometry in predicting anatomical and physiological parameters of mammals. Lab. Anim. 36: 1–19.
- Litster A. L., Buchanan J. W. 2000. Radiographic and echocardiographic measurement of the heart in obese cats. Vet. Radiol. Ultrasound 41: 320–325.
- Lott J. A., Mitchell L. C., Moeschberger M. L., Sutherland D. E. 1992. Estimation of reference ranges: how many subjects are needed? Clin. Chem. 38: 648–650.
- März I., Wilkie L. J., Harrington N., Payne J. R., Muzzi R. A. L., Häggström J., Smith K., Luis Fuentes V. 2015. Familial cardiomyopathy in Norwegian Forest cats. J. Feline Med. Surg. 17: 681–691.
- Mottet E., Amberger C., Doherr M. G., Lombard C. 2012. Echocardiographic parameters in healthy young adult Sphynx cats. Schweiz. Arch. Tierheilkd. 154: 75–80.
- Neilan T. G., Pradhan A. D., Weyman A. E. 2008. Derivation of a size-independent variable for scaling of cardiac dimensions in a normal adult population. J. Am. Soc. Echocardiogr. 21: 779–785.
- Payne J. R., Brodbelt D. C., Luis Fuentes V. 2015. Cardiomyopathy prevalence in 780 apparently healthy cats in rehoming centres (the CatScan study). J. Vet. Cardiol. 17 Suppl 1: S244–S257.
- Pipers F. S., Reef V., Hamlin R. L. 1979. Echocardiography in the domestic cat. Am. J. Vet. Res. 40: 882–886.
- Prothero J. 1979. Heart weight as a function of body weight in mammals. Growth 43: 139–150.
- Riesen S. C., Kovacevic A., Lombard C. W., Amberger C. 2007. Echocardiographic screening of purebred cats: an overview from 2002 to 2005. Schweiz. Arch. Tierheilkd. 149: 73–76.
- Riesen S. C., Schober K. E., Smith D. N., Otoni C. C., Li X., Bonagura J. D. 2012. Effects of ivabradine on heart rate and left ventricular function in healthy cats and cats with hypertrophic cardiomyopathy. Am. J. Vet. Res. 73: 202–212.
- Rovira S., Muñoz A., Rodilla V. 2009. Allometric scaling of echocardiographic measurements in healthy Spanish foals with different body weight. Res. Vet. Sci. 86: 325–331.
- Scansen B. A., Morgan K. L. 2015. Reference intervals and allometric scaling of echocardiographic measurements in Bengal cats. J. Vet. Cardiol. 17 Suppl 1: S282–S295.
- Schober K. E., Maerz I. 2005. Doppler echocardiographic assessment of left atrial appendage flow velocities in normal cats. J. Vet. Cardiol. 7: 15–25.
- Schober K. E., Savino S. I., Yildiz V. 2016. Right ventricular involvement in feline hypertrophic cardiomyopathy. J. Vet. Cardiol. 18: 297–309.
- Sugimoto K., Fujii Y., Ogura Y., Sunahara H., Aoki T. 2017. Influence of alterations in heart rate on left ventricular echocardiographic measurements in healthy cats. J. Feline Med. Surg. 19: 841–845.
- Wagner T., Fuentes V. L., Payne J. R., McDermott N., Brodbelt D. 2010. Comparison of auscultatory and echocardiographic findings in healthy adult cats. J. Vet. Cardiol. 12: 171–182.
- Wolf O. A., Imgrund M., Wess G. 2017. Echocardiographic assessment of feline false tendons and their relationship with focal thickening of the left ventricle. J. Vet. Cardiol. 19: 14–23.
^Наверх









