Электрофизиологические характеристики и топографическое расположение очаговой предсердной тахикардии у собак

Авторы: Р. Сантилли, М. Перего, А. Перини, П. Моретти, Г. Спадачини
Santilli R.A., Perego M., Perini A., Moretti P. and Spadacini G. Electrophysiologic Characteristics and Topographic Distribution of Focal Atrial Tachycardias in Dogs // J. Vet. Intern. Med. - 2010;24:539–545
Аннотация
Предпосылки: Очаговая предсердная тахикардия (FAT) является распространенной суправентрикулярной тахикардией у собак.
Цель: оценить электрофизиологические характеристики и топографическое распределение очаговой предсердной тахикардии.
Животные: Шестнадцать собак с наличием симптоматической формы очаговой предсердной тахикардии.
Методы: ретроспективные серии случаев. Электрофизиологические исследования проводились для проверки индуктивности документированных и не документированных аритмий. После индуцирования для каждой собаки очаговой предсердной тахикардии, проводили анализ на электрогенный механизм, снимали эндокардиальную электрограмму и определяли местоположение источника аритмии.
Результаты: Девятнадцать разновидностей очаговой предсердной тахикардии определены у 16 собак, 12 были автоматическими, 4 неавтоматическими и 3 постоянными. У двух собак было более 1 фокуса. Средняя длина предсердного цикла составила 238,2 ± 69,2 (SD – среднеквадратичное отклонение) миллисекунды, средняя продолжительность желудочкового цикла - 292,7 ± 72,5 (SD) миллисекунд, с атриовентрикулярным блоком в 6 случаях. Средняя предсистолическая активность предсердий, зарегистрированная в эктопическом фокусе, составляла -39,9 ± 17,7 (SD) миллисекунд. Потенциалы предсердий были фрагментированы у 11 собак и с низкой амплитудой у 6 собак. Шестьдесят три процента эктопических очагов были распределены внутри правого предсердия (5 – терминальный гребень, 3 - треугольник Коха, 2 - кольцо трикуспидального клапана, 1 - межпредсердная перегородка и 1 - правое предсердие) и 37% из легочных вен (PV) (4 – правая верхняя ветвь легочной вены, 2 - левая верхняя ветвь легочной вены и 1 - правая нижняя ветвь легочной вены). Персистирующая форма фибрилляции предсердий (AF) и пароксизмальная форма мерцательной аритмии были вызваны очаговой предсердной тахикардией у 7 собак (у двух - с несколькими эктопическими фокусами и у четырех - по меньшей мере одним фокусом из области легочных вен).
Заключение и клиническая значимость. По нашим данным, у собак преобладает правосторонняя форма очаговой предсердной тахикардии. Большинство очаговых предсердных тахикардий являются автоматическими и могут запускать фибрилляцию предсердий, особенно в случае расположения источника аритмии в области легочных вен.
Сокращение:
- CL - продолжительность цикла
- CS - коронарный синус
- FAT - очаговая предсердная тахикардия
- PV - легочные вены
- RFCA – радиочастотная катерная абляция
- SVT - суправентрикулярная тахикардия
- TICM – тахикардия-индуцированная кардиомиопатия
Очаговая предсердная тахикардия (FAT) определяется как активация предсердий, начинающаяся ритмично в небольшой области (фокусе), из которой она распространяется центробежно и без активации важной части длины цикла (CL) [1]. У людей очаговая предсердная тахикардия встречается относительно редко, с частотой 0,34% у молодых бессимптомных пациентов и 0,46% у лиц с симптомами со спонтанной ремиссией 24-63% [2]. Шестьдесят три процента пациентов с очаговой предсердной тахикардией имеют дисфункцию левого желудочка, и из них 73% имеют индуцированную тахикардией кардиомиопатию (TICM) [3].
Очаговая предсердная тахикардия обладает широким спектром электрофизиологических особенностей, который отражает, по меньшей мере, три основных электрогенных механизма: аномальный автоматизм, триггерную активность и механизм микро-риентри [4-6]. Очаговая предсердная тахикардия, вызванная триггерной активностью и микро-риентри, также называют неавтоматической FAT [7].
У людей 63% очаговых предсердных тахикардий являются правосторонними, в то время как остальные 37% возникают из левой предсердной стенки или притоковых вен (легочных вен) [8]. Очаговая предсердная тахикардия представляет собой характерное анатомическое распределение с типичной кластеризацией вокруг пограничного гребня (crista terminalis) (21%), устья и теля коронарного синуса (CS) (10%), область вокруг пучка Гиса (5%), кольца трикуспидального клапана (13-22%), кольца митрального клапана (28-36%), легочных вен (PV) (24%), правая часть межпредсердной перегородки (0,8%), левая часть межпредсердной перегородки (2%) и реже вокруг правого и левого ушка, верхней полой вены и некоронарной створки аортального клапана [9-23].
От 4 до 17% пациентов с очаговой предсердной тахикардией имеют более 1 фокуса аритмии, а наиболее распространенными комбинациями являются 2 места локализации в области свободной стенке правого желудочка (29,5%), а также свободной стенке правого желудочка и правой части межжелудочковой перегородки (15,9%) [24-25]. У лиц с множественными эктопическими очагами выявили сопутствующую сердечно-сосудистую патологию, с кратчайшей продолжительность цикла тахикардии (CL) и более низким уровнем успешности при проведении радиочастотной катетерной абляции (RFCA) [25].
Цель нашего исследования состояла в том, чтобы охарактеризовать очаговую предсердную тахикардию у группы собак, подвергшихся подробному картированию эндокарда, чтобы оценить аритмический субстрат и проанализировать топографическое расположение эктопических очагов.
Материал и методы
Популяционные исследования (объект исследования)
Были ретроспективно проанализированы записи от 16 собаках с суправентрикулярной тахикардией (SVT), которые прошли электрофизиологическое исследовние в Клинике Ветеринарии Мальпенса во время исследовательского проекта, продолжавшегося с января 2005 года по август 2008 года. В исследование вошли 16 собак, в том числе: 2 - лабрадора-ретривера, 2 - ротвейлера, 2 - боксера, 2 – бордосских дога, 2 - ньюфаундленда, 1 - беспородная, 1 - мопс, 1 – матино наполитано, 1 - бульмастиф, 1 - бультерьер и 1 – бернская пастушья овчарка (зинненхунд). Тринадцать собак были самцами со средним возрастом 51 месяц (диапазон от 5 до 156 месяцев) и средней массой тела 33 ± 17,4 кг (72,6 ± 38,3 фунтов). Каждая собака прошла физикальное обследование, 12-канальную ЭКГ с поверхности тела, грудные рентгенограммы, стандартную эхокардиографию и электрофизиологическое исследование.
Тринадцать собак были представлены для оценки эпизодической слабости из-за суправентрикулярной тахикардии (SVT), 3 собаки - для клинических признаков застойной сердечной недостаточности. Девять собак получали лечение до направления в клинику: 2 собаки - получали метопролол (0,25 мг/кг [0,11 мг/фунт] перорально каждые 12 ч), 1 собака -хинидин (6 мг/кг [2,7 мг/фунт] перорально каждые 8 ч), 1 собака - амиодарон (10 мг/кг [4,5 мг/фунт] перорально каждые 12 ч), 1 собака - соталол (0,5 мг/кг [0,22 мг/фунт] перорально каждые 12 ч), 1 собака - пропранолол (0,09 мг/кг [0,04 мг/фунт] перорально каждые 8 ч), 1 собака - дигоксин (0,0025 мг/кг [0,0011 мг/фунт] перорально каждые 12 ч), 1 собака - амиодарон (10 мг/кг [4,5 мг/фунт] перорально каждые 12 ч) в сочетании с пропранололом (0,09 мг/кг [мг/фунт ] перорально каждые 8 ч) и 1 собака - соталол (0,5 мг/кг [0,22 мг/фунт] перорально каждые 12 ч) в комбинации с дигоксином (0,0025 мг/кг [мг/фунт] перорально каждые 12 ч). При представлении к исследованию у 4 собак на ЭКГ был ритм, совместимый с персистирующей фибрилляцией предсердий (AF), у 3 собак - постоянная узкая QRS-комплексная тахикардия и у 9 собак - нормальный синусовый ритм. Рентгенографические и эхокардиографические данные были нормальными у 12 собак; они были диагностическими для тахи-индуцированной кардиомиопатии у 3 собак и для хронической болезни клапанов у 1 собаки.
Интервенционная процедура
Электрофизиологические исследования проводились под общей анестезией, как описано ранее [26], после прекращения приема антиаритмических препаратов в течение, по меньшей мере, пяти периодов полувыведения [27]. Собаку помещали в дорсальное положение, а венозный доступ получали путем модифицированной методики Селдингера. При проведении рентгеноскопии и внутрисердечной ЭКГ один мультиполярный электродный катетер вводили через правую наружную яремную вену в область коронарного синуса. 2-й декаполярный электродный катетер был вставлен через правую бедренную вену и помещена вокруг фиброзного кольца трехстворчатого клапана, чтобы зафиксировать с проксимальными электродными парами потенциалы передне-латеральной части пограничного гребня (криста терминалис) (высокая часть правого предсердия), а средние пары - потенциалы средней боковой части правого предсердия (средняя часть правого предсердия атриум), а с дистальными парами - низкие потенциалы нижне-боковой части правого предсердия (нижняя часть правого предсердия) (рис. 1А). Семифренчевый абляционный катетер, 8 мм, с отклоняющимся кривым наконечником, продвигался через правую бедренную вену и размещался поочередно у пучка Гиса, правого желудочка и другой области стенки правого предсердия, чтобы отображать внутриполостные электрограммы и выполнять запрограммированную стимуляцию.
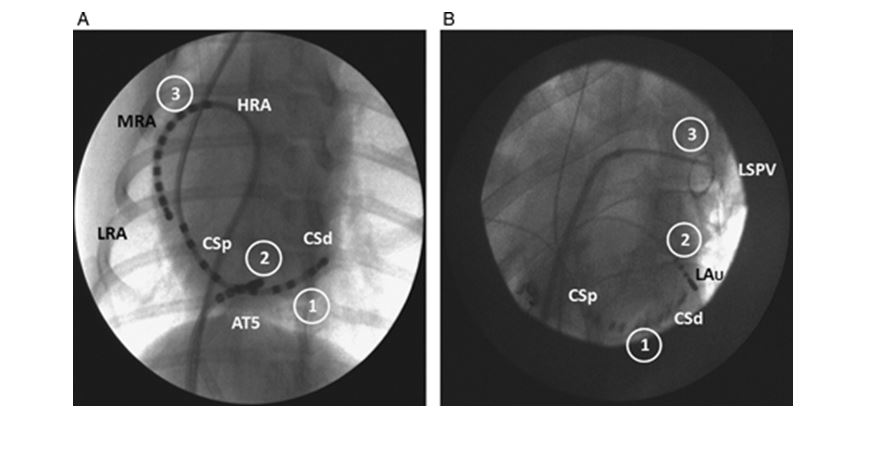
Рисунок 1. (A) Вентро-дорсальная наклонная (на 30 ° слева от сагиттальной плоскости) рентгеноскопическая картина грудной клетки собаки, полученная при эндокардиальном картировании предсердной тахикардии из области коронарного синуса предсердия.
1, катетер декаполярного электрода коронарного синуса; 2, катетер абляции, отображающий область коронарного устья; 3, катетер декаполярного электрода правого предсердия. HRA, верхняя часть правого предсердия; MRA, средняя часть правого предсердия; LRA, нижняя часть правого предсердия; CSp, проксимальный коронарный синус; CSd, коронарный синус дистальный; AT5, устье коронарного синуса. (B) Вентро-дорсальная косая (на 30 ° слева от сагиттальной плоскости), рентгеноскопическое изображение грудной клетки собаки, полученное при эндокардиальном картировании левой верхней предсердной тахикардии из области легочной вены. 1, катетер декаполярного электрода коронарного синуса; 2, отображение абляционного катетера в левом предсердии; 3, круговое лассо-декаполярное отображение катетера левой верхней легочной вены. LAu, левое ушко; LSPV, левая верхняя легочная вена.
Чтобы отобразить левую стенку предсердной стенки или эктопические очаги из легочных вен, трансептальная пункция была предложена хозяину и выполнена по методике Brockenbrough [28], полученной в 1960 году. Из правой бедренной вены под рентгеноскопическим контролем специально разработанный направляющий проводник, вставленный в трансептальной иглопробивной позиции, был помещен через овальную ямку в левое предсердие. Движение кончика иглы, напоминающее «прыжок» от более толстой мускульной перегородки к тонкой стенке овальной ямки, было косвенным радиологическим знаком положения овальной ямки. Как только проволока попала в левое предсердие, специальная игла была сдвинута через межпредсердную перегородку, чтобы произвести большее отверстие, затем набор для введения был оставлен на месте и использовался для направления и картирования аблационных катетеров [28, 29]. Катетер Лассо использовался для отображения устья легочных вен, в то время как катетер абляции для картирования эктопических очагов на левой стенке предсердия, легочных вен и левого ушка (рис. 1B). В случае, если владелец отказывался от трансептальной пункции, левые предсердные тахикардии, особенно очаговая предсердная тахикардия, происходящяя из правой верхней легочной вены, были идентифицированы на протяжении всего анализа двойных потенциалов, записанных в высокой задней части правого предсердия [22]. Во время тахикардии, если амплитуда 1-го потенциала была больше чем у 2-го потенциала, это указывало на правильный задний предсердный фокус; в противоположном случае был поставлен диагноз правый верхний фокус легочной вены [22].
Двенадцать отведений ЭКГ и внутрисердечных сигналов были отображены и проанализированы с помощью ЭФИ-рекордера при скорости бумаги 100 или 200 мм/с. Интракардиальные электрограммы регистрировались при настройке фильтра 50-500 Гц. Шаг проводили с использованием стимулов, которые были с дважды диастолическим порогом и продолжительностью 2 мс.
При базальном состоянии регистрировались антеградное и ретроградное время атриовентрикулярной (АВ) проводимости. Запрограммированная стимуляция предсердий и желудочков, импульс предсердной стимуляции и изопротеренола гидрохлорид 0,04-0,1 мкг/кг/мин в виде внутривенной инфузии с постоянной скорости использовали для проверки индуктивности документированных и недокументированных аритмий и для проверки аритмогенного механизма.
Увлечение механизма тахикардии использовалось для дифференциации реципрокной тахикардии от очаговой предсердной тахикардии. После овердрайвной предсердной стимуляции из области коронарного синуса во время тахикардии наличие переменной (> 10 мс от базовой линии) желудочково-предсердного интервала после стимуляции считалось диагностическим для очаговой предсердной тахикардии [4, 30] рецидивирующие предсердные тахикардии определялись методом по увлечению со скрытым слиянием. Раздражение на 10-20 мс быстрее, чем предсердная тахикардия на участке с пресистолической активностью или средним диастолическим потенциалом, может увлекать тахикардию по типу ри-ентри на скорость стимуляции без изменения морфологии зубца Р или последовательности внутрисердечных электрограмм. Тупиковая стимуляция исключалось, если интервал после размещения при прекращении скрытого увлечения был идентичен продолжительности цикла тахикардии [4, 31].
Мы определили электрогенный механизм аритмии как ненормальный автоматизм в случае, если тахикардия могла быть инициирована только инфузией изопротеренола, не было никакого эффекта запрограммированной стимуляции ни на инициирование, ни на прекращение тахикардии, а когда было получено кратковременное подавление тахикардии при овердрайвной стимуляцией, мы считали, что электрогенный механизм неавтоматический, когда инициирование тахикардии воспроизводимо с повышенной предсердной стимуляцией, запрограммированной предсердной стимуляцией или ипульсом предсердного стимуляции [4, 32].
Эктопические очаги предсердий локализовались как место ранней пресистолической активности по отношению к началу зубца Р во время тахикардии (обычно более 20-30 мс), где появилась четкая и отрицательная однополярная запись с картиной QS [4, 33] (рис. 2A-D ).
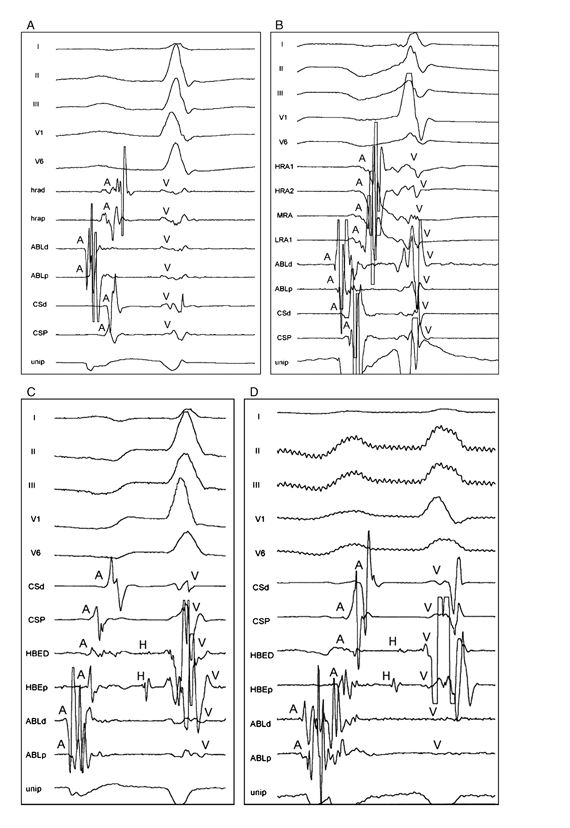
Рисунок 2. Поверхностная и внутрисердечная ЭКГ, полученная от 4 собак при картировании левого верхнего фокуса легочной вены (А), фокуса устья коронарного синуса (В), фокуса заднего угла трикуспидального клапана (С) и фокуса пограничного гребня (криста терминалис) (D).
Показанные записи у всех собаки включают в себя отведения I, II, III, V1, V6 поверхностной ЭКГ и внутрисердечные записи от дистальной части к проксимальной части коронарного синуса (CSp и CSd), от дистальной к проксимальной части различных предсердные эктопические очаги (ABLd и ABLp) и однополярная запись (unip); и внутрисердечная запись от дистальной части к области проксимального кристального конца (hrad and hrap) у собаки A, от стенки верхней часть правого предсердия, через среднюю к нижней части задней стенки правого предсердия (HRA1, HRA2, MRA, LRA1) у собаки B, и от дистальной к проксимальной области его пучка (HBED и HBEp) у собак C и D. Обратите внимание на пресистолический, фракциональный потенциал при предсердном потенциале (A), записанный с дистальными парами абляционного катетера и острых и отрицательных с морфологией QS предсердного потенциала однополярной записи в целевой области. A, предсердный потенциал; V, желудочковый потенциал; H, потенциал пучка Гиса.
Когда возникло затруднение с определением начала зубца Р, прохождение желудочкового экстрасимула позволила активировать и деполяризировать желудочки и различие эктопического зубца Р [34]. Механическое прерывание, вызванное применением давления к фокусу и наличием фрагментированных, длинных, низкоамплитудных электрограмм считались другими диагностическими инструментами для идентификации места происхождения очаговой предсердной тахикардии. Фракционированный потенциал состоял из 3 или более последовательных отрицательных прогибов с низкой амплитудой пиков (рис. 2A-D) [35,36]
Наличие дезорганизованной предсердной активности, характеризующейся нерегулярными f-волнами с переменным напряжением, считалось диагностическим для фибрилляции предсердий [34]. Когда атриальная фибрилляция уже присутствовала или индуцировалась во время исследования, для восстановления синусового ритма использовалась трансторакальная электрическая кардиоверсия с биполярным шоком.
Результаты
Девятнадцать типов очаговой предсердной тахикардии можно было изучить у 16 собак, 12 - были индуцированы инфузией изопротеренола, 4 - всплесками предсердной стимуляции, а 3 - были постоянными. Две собаки представили более 1 фокуса аритмии, 1-я собака имела 1 фокус вдоль пограничного гребня, заднего угла кольца трехстворчатого клапана и правой верхней легочной вены; 2-я собака имела 1 фокус в правой верхней легочной вене и правой нижней легочной вене. 4 собаки с устойчивой формой фибрилляции предсрдий реагировали на двухфазную электрическую кардиоверсию; синусовый ритм был восстановлен у 3 из этих собак, в то время как у 4-й была устойчивая фокальную соединительную тахикардию после кардиоверсии, а затем очаговая предсердная тахикардия, как только была начата инфузия изопротеренола. В соответствии с индукционным режимом мы классифицировали электрохимический механизм тахикардии как ненормальный автоматизм у 12 собак и как неавтоматическую у 4 собак.
Индуцированная очаговая предсердная тахикардия показала средний предсердный цикл тахикардии 238,2 ± 69,2 мс (средний ± SD) и средний желудочковый цикл тахикардии 292,7 ± 72,5 мс (среднее ± SD). Шесть тахикардий проводились с разной степенью AV-блока (у 4 собак - AV 2-й степени тип 2, у 1 собаки - AV блок 2-й степени 3:1 и у 1 собаки - AV - блок переменной степени).
Для сопоставления левосторонних форм очаговой предсердной тахикардии выполнялась трансептальная пункция в 3 случаях, тогда как эндокардиальное картирование правой задней стенки предсердия выполнялось в 4 случаях. При эндокардиальном картировании эктопических очагов средняя активность пресистолического периода предсердия была равна -39,9 ± 17,7 мс (среднее ± SD), а предсердные потенциалы были фрагментированы в 11 случаях с малой амплитудой в 6 случаях.
Эктопические очаги были распределены в правом предсердии в 63% случаев (5 – пограничный гребень, 3 – треугольник Коха, 2 – трикуспидальное кольцо, 1 – межпредсердная перегородка и 1 – правое предсердие) и в области легочных вен в 37% случаев (4 - правая верхняя легочная вена, 2 левая верхняя легочная вена и 1 правая нижняя легочная вена) (рис. 3). Одна собака с персистирующей фибрилляцией предсердий представляла 3 сопутствующих эктопических очага (1 фокус вдоль пограничного гребня, 1 - в заднем угле трикуспидального кольца и 1 - в правой верхней легочной вены), остальные 3 собаки имели 1 фокус на вершине треугольника Коха, в области пограничного гребня (crista terminalis) и левой верхней легочной вены, соответственно.
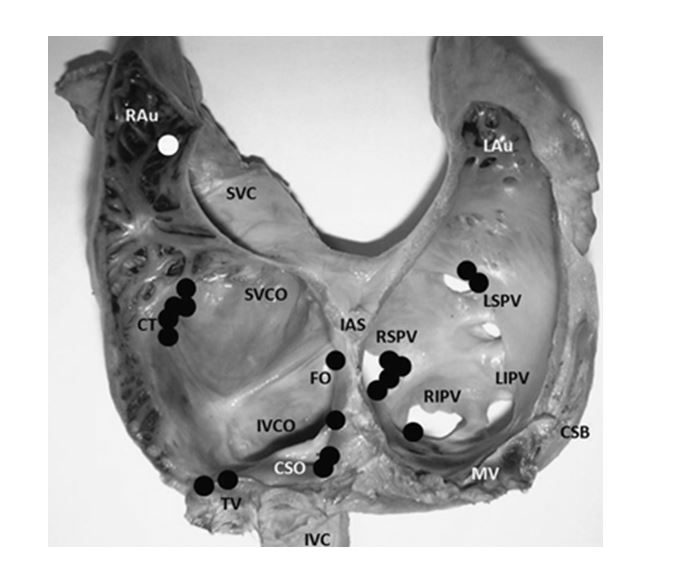
Рисунок 3. Большой анатомический разрез правого и левого предсердия и приходящих вен, показывающий топографическое распределение 19 предсердных эктопических очагов (кругов) у 16 собак с симптоматическими очаговыми предсердными тахикардиями.
Rau, правое ушко; SVC, верхняя или краниальная полая вена; SVCO, устье краниальной полой вены; CT, crista terminalis – пограничный гребень; IAS, межпредсердная перегородка; FO, fossa ovalis – овальное окно; IVCO, устье нижней или каудальной полой вены; CSO, устье коронарного синуса; TV, трехстворчатый клапан; IVC, нижняя или каудальная полая вена; LAu, ушко левого предсердия; LSPV, левые верхние легочные вены; LIPV, левые нижние легочные вены; RSPV, правые верхние легочные вены; RIPV, правые нижние легочные вены; MV, листок митрального клапана; CSB, тело коронарного синуса.
Пароксизмальная форма фибрилляции предсердий была вызвана автоматическими очаговыми предсердными тахикардиями в 3 случаях и неавтоматическим очаговыми предсердными тахикардиями в 1 случае. У всех этих собак только задокументировали суправентрикулярную тахикардию, а предсердные очаги были расположены, соответственно, в правых верхних легочных венах, в правых верхних и правых нижних легочных венах, в устье коронарного синуса и заднем угле кольца трикуспидального клапана.
Обсуждение
В этом исследовании мы проанализировали 19 очаговых предсердных тахикардий у 16 собак, которые подверглись электрофизиологическому исследованию для документирования типа суправентрикулярной тахикардии (SVT). Аналогичным образом, первое появление клинических признаков, связанных с очаговой предсердной тахикардией (FAT), обычно встречается в 1-й половине жизни человека (от 10 до 40 лет), что согласуется с возрастом собак в этом отчете [37]. Очаговая предсердная тахикардия индуцирует дисфункцию левого желудочка у 63% пациентов, 73% из которых имели тахикардия-индуцированную кардиомиопатию (TICM – тахикардиомиопатию). В последней группе пациентов очаговая предсердная тахикардия вызывается в 80% случаев аномальным автоматизмом. Мы обнаружили тахикардиомиопатию (TICM) у 4 собак (21%), у 2 из которых аритмия была вызвана аномальным автоматизмом. По нашему мнению, разница в появлении тахикардиомиопатии (TICM), обнаруженная у нашей выборки собак, по сравнению с людьми, может быть из-за небольшого числа изученных собак, потому что частота желудочков при очаговой предсердной тахикардии, наблюдаемая в этом исследовании, колеблется между 164 и 270 уд/мин и была выше, чем у людей (130-240 ударов в минуту) [4, 8, 36, 38-41].
Механизм очаговой предсердной тахикардии может быть определен по индукционному режиму [4-6]. Зарегистрированная частота очаговой предсердной тахикардии, вызванная аномальным автоматизмом у людей, колеблется от 7 до 16%, в то время как неавтоматические очаговые предсердные тахикардии варьируются от 4 до 20% [4, 38, 40]. Большинство тахикардий (63%) данной серии случаев считались автоматическими, поскольку они были индуцибельны только при инфузии изопротеренола, в то время как в меньшем числе случаев (21%) наблюдалась воспроизводимая индукция с предсердной стимуляцией, характерная реакция как для микро-риентри, так и для триггерной активности. Мы не могли дифференцировать очаговые предсердные тахикардии, вызванные микро-риентри от тахикардий, вызванных триггерной активностью из-за совпадения по ответу увлечения, отсутствием анализа потенциала монофазного действия и трудностью проверки достижения воспроизводимого цикла тахикардии предсердной стимуляции перед началом очаговой предсердной тахикардии (FAT) [4, 38, 40].
При всех записанных тахикардиях мы могли бы исключить макро-риентри предсердий из-за наличия важной части продолжительности цикла (изоэлектрический интервал на поверхности ЭКГ) без электрической активации, наличие пресистолической активации предсердия с часто фрагментированными и низкоамплитудными потенциалами и невозможностьь захватить предсердную тахикардию с 2 участков более 2 см друг от друга [1, 4, 33, 35].
Разная степень AV-блокады, главным образом 2:1, которая не влияла на тахикардию, была обнаружена в 6 из 19 случаев. Этот параметр считается дополнительным диагностическим критерием очаговой предсердной тахикардии у людей [40-41].
Место возникновения тахикардии идентифицировали путем проведения эндокардиального картирования правого предсердия, левого предсердия и входящих вен, ища участок ранней пресистолической активности по отношению к началу зубца Р во время тахикардии, где может быть записанная острая и отрицательная однополярная электрограмма с морфологией QS [4, 33]. В нашей группе собак среднее расстояние между началом активации предсердий и началом зубца Р составляло -39,9 ± 17,7 мс. Результат был похож на исследованиями у людей (-21 и -51 мс) [4, 7, 15, 36, 38-43]. Наличие негативных однополярных записей с конфигурацией QS было связано с правильной идентификацией целевого участка для успешной абляции с зарегистрированным успехом в 86% случаев [33, 40]. В нашем исследовании все целевые области абляции представили указанную выше однополярную деформационную морфологию.
Области, в которых возникают очаговые предсердные тахикардии, характеризуются фракционированными электрограммами, которые могут отражать локализованное замедление предсердной проводимости, вызванное плохо связанным фокусом автоматизма или цепью микро-риентри [15, 35, 43]. Мы записали фракционированные электрограммы более чем в половине случаев тахикардии, исследованных с низким пиком амплитуды у 1 из 3 из них.
Мы могли выполнять левое предсердное картирование и картирование легочных вен после трансептальной пункции у 3 собак, в то время как у 4 собак мы идентифицировали правильные потенциалы из области легочных вен, выявленные двойными потенциалами, записываемыми в верхней задней части правого предсердия [22]. Тахикардии, возникающие из задней стенки правого предсердия и правой легочной вены обладают подобными электрофизиологическими характеристиками, поскольку они анатомически расположены рядом друг с другом. Двойные потенциалы вызваны биатриальной электрической активацией и в соответствии с амплитудой 1-го или 2-го отклонения, что дает возможность дифференцировать задний правый предсердный или правый верхний фокус аритмии из области легочной вены [22]. Ограничение данной методики заключается в том, что электрофизиологические особенности очаговой предсердной тахикардии, возникающие из задней правой предсердной стенки вблизи предсердной перегородки и те, которые возникают из правой нижней легочной вены, пока не известны.
Топографическое распределение эктопических очагов предсердий, обнаруженное в настоящем исследовании, похоже на те, которые были зарегистрировано у людей, где 63% тахикардий возникают из правого предсердия и 37% из левого предсердия [8]. В нашем исследовании 63% случаев очаговой предсердной тахикардии (FAT) произошли из правого предсердия, а 37% - из левого предсердия. У людей кластеры эктопических очагов предсердий чаще всего находятся вокруг терминального гребня (crista terminalis), кольца трикуспидального клапана, устья коронарного синуса, перинодальной области, в области легочных вен и вокруг митрального кольца, а реже - в правой и левой межпредсердной перегородке, правом и левом ушке, верхней полой вене и некоронарной створке аортального клапана [9-23]. Аналогичным образом, в нашем исследовании главным образом очаговая предсердная тахикардия у собак (FAT) возникла из области crista terminalis, треугольника Коха, кольца трикуспидального клапана и легочных вен.
В человеческой литературе 4-17% пациентов с очаговыми предсердными тахикардиями (FAT) и более 1-го фокуса выявили сопутствующую сердечно-сосудистую патологию, более быструю тахикардию и более низкий показатель успешности радиочастотной катетерной абляции [24-25]. Мы обнаружили у 2 собак несколько очагов тахикардии, локализованных в стенке правой предсердия и области легочных вен в первом случае и в правой верхней и правой нижней легочной вене во втором случае. У одной из этих собак была тахикардиомиопатия и стойкая фибрилляция предсердий, а у другой была неудачная абляция.
Спонтанное инициирование фибрилляции предсердий с помощью эктопических стимулов, происходящих из области легочных вен, описано у людей [23]. Левая предсердная стенка переходит в легочные вены как мышечные вставки со средней длиной 13 мм и максимальной длиной 25 мм [44]. Самые длинные «мышечные рукава» были найдены в верхних легочных венах и этот анатомический рисунок коррелирует с относительным распределением фокусов аритмии из области легочных вен у людей [23] и встречалось у собак в сериях наших случаев. Устье и начальная часть легочной вены представляют собой внезапное изменение ориентации волокон с площадью медленной проводимости и фракционированными сигналами [45]. У пациентов с пароксизмальной фибрилляцией предсердия отмечались более короткие эффективные и функциональные рефрактерные периоды в области легочных вен, которые наряду со сниженной проводимостью между легочными венами и левым предсердием и медленной проводимостью в легочных венах облегчили механизм ри-ентри [46]. В нескольких исследованиях было высказано предположение о том, что как аномальный автоматизм, так и триггерная активность в легочных венах, либо самостоятельно, либо в сочетании с механизмом повторного входа могут играть роль в инициировании фибрилляции предсердий [47].
Мы идентифицировали стойкую и пароксизмальную формы фибрилляции предсердий, вызванную триггерной очаговой предсердной тахикардией у 7 собак, 2 из которых имели несколько эктопических очагов и 4 из которых имели по меньшей мере 1 фокус, расположенный в области легочных вен.
Сноски
- a - Polaris X, 7F, 2/5/2, Boston Scientific Corp, Genova, Италия
- b - Polaris C, 4 мм, 7F; Boston Scientific Corp
- c - TS проводник, Safe Set, SS120, Mennen Medical, Manta, Genova, Италия
- d – Угловая игла 71 см, 1,02 мм - St Jude Medical Italia SpA, Agrate Brianza, Милан, Италия
- е -декаполярный круглый катетер eLasso, Biosense, Вебстер, Милан, Италия
- f – аппарат для электрофизиологического исследования, 16 каналов, Mennen Medical
Благодарности
Авторы благодарны д-ру Хайди Куперу и Луке Ферасину за рассмотрение рукописи и доктору Луке Пивинини за консультирование по общей патологии.
Литература
- Saoudi N, Cosio F, Waldo A, et al. A classification of atrial flutter and regular atrial tachycardia according to electrophysiological mechanisms and anatomical bases: A statement from a joint expert group from the working group of arrhythmias of the European society of cardiology and the North American society of pacing and electrophysiology. Eur Heart J 2001;22:1162–1182.
- Poutiainen AM, Koistinen MJ, Airaksines KE, et al. Prevalence and natural course of ectopic atrial tachycardia. Eur Heart J 1999;20:694–700.
- Chen SA, Tai CT, Chiang CE, et al. Focal atrial tachycardia: Reanalysis of the clinical and electrophysiologic characteristics and prediction of successful radiofrequency ablation. J Cardiovasc Electrophysiol 1998;9:355–365.
- Chen SA, Chiang CE, Yang CJ, et al. Sustained atrial tachycardia in adult patients: Electrophysiological characteristics, pharmacological response, possible mechanisms, and effects of radiofrequency ablation. Circulation 1994;90:1262–1278.
- De Bakker JM, Hauer RN, Bakker PF, et al. Abnormal automaticity as mechanism of atrial tachycardia in the human heart—electrophysiologic and histologic correlation: A case report. J Cardiovasc Electrophysiol 1994;5:335–344.
- Wyndham CR, Arnsdorf MF, Levitisky S, et al. Successful surgical excision of focal paroxysmal atrial tachycardia. Observations in vivo and in vitro. Circulation 1980;62:1365–1372.
- Kammeraad JA, Balaji S, Oliver RP, et al. Nonautomatic focal atrial tachycardia: Characterization and ablation of a poorly understood arrhythmia in 38 patients. Pacing Clin Electrophysiol 2003;26:736–742.
- Kistler PM, Thomson KC, Haqqani HM, et al. P-wave morphology in focal atrial tachycardia. J Am Coll Cardiol2006;48:1010–1017.
- Badhwar N, Kalman JM, Sparks PB, et al. Atrial tachycardia arising from the coronary sinus musculature: Electrophysiological characteristics and long-term outcomes of radiofrequency ablation. J Am Coll Cardiol 2005;46:1921–1930.
- Chang KC, Lin YC, Chen JY, et al. Electrophysiological characteristics and radiofrequency ablation of focal atrial tachycardia originating from the superior vena cava. Jpn Circ J 2001;65:1034–1040.
- Chen CC, Tai CT, Chiang CE, et al. Atrial tachycardias originating from the atrial septum: Electrophysiologic characteristics and radiofrequency ablation. J Cardiovasc Electrophysiol 2000;11:744–749.
- Das S, Neuzil P, Albert CM, et al. Catheter ablation of peri-AV nodal atrial tachycardia from the noncoronary cusp of the aortic valve. J Cardiovasc Electrophysiol 2008;19:231–237.
- Freixa X, Berruezo A, Mont L, et al. Characterization of focal right atrial appendage tachycardia. Europace2008;10:105–109.
- Hachiya H, Ernst S, Ouyang F, et al. Topographic distribution of focal left atrial tachycardias defined by electrocardiographic and electrophysiological data. Circ J 2005;69:205–210.
- Kalman JM, Olgin JE, Karch MR, et al. “Cristal tachycardia”: Origin of right atrial tachycardia from the crista terminalis identified by intracardiac echocardiography. J Am Coll Cardiol 1998;31:451–459.
- Kistler PM, Sanders P, Fynn S, et al. Electrocardiographic characteristics of focal atrial tachycardia originating from pulmonary veins. Circulation 2003;108:1968–1975.
- Kistler PM, Sanders P, Hussin A, et al. Focal atrial tachycardia originating from the mitral annulus: Electrocardiographic and electrophysiologic characterization. J Am Coll Cardiol 2003;41:2212–2219.
- Kriatselis C, Roser M, Min T, et al. Ectopic atrial tachycardias with early activation at his site: Radiofrequency ablation through a retrograde approach. Europace 2008;10:698–704.
- Morton JB, Sanders P, Das A, et al. Focal atrial tachycardia arising from the tricuspid annulus: Electrophysiologic and electrocardiographic characteristics. J Cardiovasc Electrophysiol 2001;12:653–659.
- Ouyang F, Ma J, Ho SY, et al. Focal atrial tachycardia originating from the non-coronary aortic sinus: Electrophysiological characteristics and catheter ablation. J Am Coll Cardiol 2006;48:122–131.
- Phillips KP, Natale A, Sterba R, et al. Percutaneous pericardial instrumentation for catheter ablation of focal atrial tachycardias arising from the left atrial appendage. J Cardiovasc Electrophysiol 2008;19:430–433.
- Yamada T, Murakami Y, Muto M, et al. Electrophysiologic characteristics of atrial tachycardia originating from the right pulmonary veins or posterior right atrium: Double potentials obtained from the posterior wall of the right atrium can be useful to predict foci of atrial tachycardia in right pulmonary veins or posterior right atrium. J Cardiovasc Electrophysiol 2004;15:745–751.
- Haissaguerre M, Jais P, Shah DC, et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med 1998;339:659–666.
- Hillock RJ, Kalman JM, Roberts-Thomson KC, et al. Multiple focal atrial tachycardias in a healthy adult population: Characterization and description of successful radiofrequency ablation. Heart Rhythm 2007;4:435–438.
- Hu YF, Higa S, Huang JL, et al. Electrophysiologic characteristics and catheter ablation of focal atrial tachycardia with more than one focus. Heart Rhythm 2009;6:198–203.
- Santilli RA, Spadacini G, Moretti P, et al. Radiofrequency catheter ablation of concealed accessory pathways in two dogs with symptomatic atrioventricular reciprocating tachycardia. J Vet Cardiol 2006;8:157–165.
- Wright KN, Mehdirad AA, Giacobbe P, et al. Radiofrequency catheter ablation of atrioventricular accessory pathways in 3 dogs with subsequent resolution of tachycardia-induced cardiomyopathy. J Vet Intern Med1999;13:361–371.
- Brockenbrough E, Braunwald E. A new technique for left ventricular angiography and trans-septal left heart catheterization. Am J Cardiol 1960;6:219–231.
- Roelke M, Smith AJ, Palacios IF. The technique and safety of trans-septal left heart catheterization: The Massachusetts General Hospital experience with 1,279 procedures. Cath Cardiovasc Diagn 1994;32:332–339.
- Colombowala IK, Massumi A, Rasekh A, et al. Variability in post-pacing intervals predicts global atrial activation pattern during tachycardia. J Cardiovasc Electrophysiol 2008;19:142–147.
- Stevenson WG, Sager PT, Friedman PL. Entrainment techniques for mapping atrial and ventricular tachycardias. J Cardiovasc Electrophysiol 1995;6:201–216.
- Lin YJ, Tai CT, Huang JL, et al. Characterization of right atrial substrate in patients with supraventricular tachycardia. J Cardiovasc Electrophysiol 2005;16:173–180.
- Tang K, Ma J, Zhang S, et al. Unipolar electrogram in identification of successful targets for radiofrequency catheter ablation of focal atrial tachycardia. Chin Med J Engl 2003;116:1455–1458.
- Josephson ME. Electrophysiologic investigation. In: JosephsonME, ed. Clinical Cardiac Electrophysiology. Technique and Interpretations, 3rd ed. Philadelphia, PA: Lippincott Williams & Wilkins; 2002:322–424.
- De Groot NM, Schalij MJ. Fragmented, long-duration, low-amplitude electrograms characterize the origin of focal atrial tachycardia. J Cardiovasc Electrophysiol 2006;17:1086–1092.
- Pappone C, Stabile G, De Simone A, et al. Role of catheter-induced mechanical trauma in localization of target sites of radiofrequency catheter ablation in automatic atrial tachycardia. J Am Coll Cardiol 1996;27:1090–1097.
- Rodriguez LM, De Chillou C, Schlapfer J, et al. Age at onset and gender of patients with different types of supraventricular tachycardias. Am J Cardiol 1992;70:1213–1215.
- Golberger J, Kall J, Ehlert F, Deal B, et al. Effectiveness of radiofrequency catheter ablation for treatment of atrial tachycardia. Am J Cardiol 1993;72:787–793.
- Tracy CM, Swartz JF, Fletcher RD, et al. Radiofrequency catheter ablation of ectopic atrial tachycardia using paced activation sequence mapping. J Am Coll Cardiol 1993;21:910–917.
- Poty H, Saoudi N, Haissaguerre M, et al. Radiofrequency catheter ablation of atrial tachycardias. Am Heart J1996;131:481–489.
- Anguera I, Brugada J, Roba M, et al. Outcomes after radiofrequency catheter ablation of atrial tachycardia. Am J Cardiol 2001;87:886–890.
- Walsh EP, Saul JP, Hulse JE, et al. Transcatheter ablation of ectopic atrial tachycardia in young patients using radiofrequency current. Circulation 1992;86:1138–1146.
- Wang L, Weerassoriya HR, Davis MJ. Radiofrequency catheter ablation of atrial tachycardia. Aust NZ J Med1995;25:127–132.
- Nathan H, Eliakim M. The junction between the left atrium and the pulmonary veins. An anatomic study in human hearts. Circulation 1966;34:412–422.
- Hocini M, Ho SY, Kawara T, et al. Electrical conduction in canine pulmonary veins: Electrophysiological and anatomic correlation. Circulation 2002;105:2442–2448.
- Jais P, Hocini M, Mackle I, et al. Distinctive electrophysiological properties of pulmonary veins in patients with atrial fibrillation. Circulation 2002;106:2479–2485.
- Chen YJ, Chen SA, Chang MS, et al. Arrhythmogenic activity of cardiac muscle in pulmonary veins of the dog: Implication for the genesis of atrial fibrillation. Cardiovasc Res 2000;48:265–273.
^Наверх









