Застойная сердечная недостаточность - терминология, общие сведения, суть проблемы

В основе застойной сердечной недостаточности лежит неспособность сердца как насоса обеспечить снабжение организма и тканей кровью в объеме, необходимом для их нормального метаболизма в состоянии покоя и / или при умеренных физических нагрузках. Не существует удовлетворительного определения «метаболических потребностей» тканей, отсутствует и достаточно четкая разделительная грань между «чистым» заболеванием сердца и начальными признаками застойной сердечной недостаточности, которая при нем возникает.
Поскольку застойной сердечной недостаточности конечное проявление действия различных патологических и биохимических процессов, более точного патофизиологического или клинического определения застойной сердечной недостаточности не существует. Одной из основных причин сердечной недостаточности застойного типа является острый инфаркт миокарда (ОИМ), который многократно увеличивает риск ее возникновения. По данным Фремингемского исследования, ХСН развивается в течение 5 лет у 14 % больных, перенесших ОИМ. Среди осложнений инфаркта миокарда ХСН занимает второе место после аритмий.
Наиболее прогностически неблагоприятными факторами развития застойной сердечной недостаточности в постинфарктном периоде являются наличие артериальной гипертензии, стенокардия давностью более одного года до ОИМ, повторность инфаркта, передняя его локализация, наличие признаков левожелудочковой недостаточности в первые сутки инфаркта и к моменту выписки из стационара, снижение УИ и увеличение КСО левого желудочка с первых суток заболевания.
Важным патогенетическим процессом при застойной сердечной недостаточности является ремоделирование левого желудочка, которое определяется как комплекс процессов адаптации (а позднее дезадаптации) структуры и функции миокарда после ОИМ. Термин «ремоделирование сердца» был введен в литературу в конце 70-х годов N. Sharpе для обозначения структурных и геометрических изменений после ОИМ [143, 145]. После повреждения и гибели части кардиомиоцитов как в нормальном, так и в поврежденном миокарде происходят биологические процессы, ведущие к склерозированию погибших миоцитов и установлению фиброза, гипертрофии оставшихся миоцитов с изменением их взаиморасположения, изменению геометрии и размеров полости левого желудочка. В зависимости от промежутка времени, прошедшего от начала инфаркта миокарда, выделяют раннее (с 1-го дня до 3-4-й недели) и позднее (в более поздние сроки) ремоделирование. С точки зрения морфологии через 2 - 4 дня от начала инфаркта миокарда наблюдается увеличение миокардиоцитов в размерах как в пограничной зоне, так и в неповрежденном миокарде (с возрастанием их объема на 16 - 22 % и длины на 11 - 13 %).
Кроме того, выявляются скольжение миокардиоцитов и их волокон друг относительно друга, нарушение взаимной ориентации миокардиоцитов. В более поздние сроки (3 - 6 недель от начала инфаркта миокарда) имеет место увеличение степени выраженности перечисленных процессов: объем миокардиоцитов увеличивается в пограничной зоне на 35 - 80 %, в неповрежденном миокарде – на 15 - 33 %; их длина в пограничной зоне возрастает на 25 - 33 %, причем степень выраженности этих изменений выше при более значительной площади инфаркта миокарда. Также регистрируется скольжение миокардиоцитов и их волокон относительно друг друга с нарушением взаимного расположения. На 3 - 6-й неделе инфаркта выявляется уменьшение плотности капилляров в пограничной зоне на 14 %, в неповрежденном миокарда на 8 %, имеет место скольжение капилляров относительно кардиомиоцитов. Важное место занимают изменения фибробластов и коллагена, которые обеспечивают образование фиброзного рубца в зоне миокарда, реактивный фиброз в пограничной зоне и, частично, в интактном миокарде. При избыточном расщеплении коллагена увеличивается податливость миокарда, что предрасполагает к дилатации и систолической дисфункции. При снижении деградации коллагена увеличивается жесткость миокарда с его диастолической дисфункцией. Важнейшими составляющими постинфарктного ремоделирования являются «экспансия инфаркта», дилатация левого желудочка и гипертрофия непораженных сегментов.
«Экспансия инфаркта» это острое увеличение и истончение зоны инфаркта, непропорциональная дилатация инфарцированного сегмента, наблюдаемые в сроки от 1 дня до 3 - 4-й недели после начала инфаркта миокарда и не связанные с дополнительным ишемическим некрозом миокарда. Этот процесс может быть распознан эхокардиографически как увеличение зоны акинезии, не сопровождающееся повышением уровня кардиоспецифических ферментов. Утолщение свободной стенки левого желудочка в систолу в норме составляет более чем 50 % относительно исходной толщины в диастолу. При гипокинезии систолическое утолщение варьирует в диапазоне от 10 до 40 %, при акинезии составляет менее 10 % от исходной толщины в диастолу. При возрастании выраженности ремоделирования резко возрастает риск внутриполостного тромбооразования. «Экспансия инфаркта» развивается не при каждом инфаркте миокарда. Ее выраженность зависит от его локализации и особенностей внутрисердечной гемодинамики. Однако именно наличие «экспансии инфаркта» приводит к развитию таких осложнений, как сердечная недостаточность, аневризма и разрыв миокарда. Аневризма левого желудочка как вариант постинфарктного ремоделирования является одним из наиболее частых осложнений инфаркта миокарда и развивается у 8 - 38 % больных. Развитие клинических признаков застойной сердечной недостаточности у этих больных обусловлено в первую очередь размерами аневризмы: при обширных аневризмах левого желудочка сердечной недостаточности застойного типа наблюдается в 70,4 % случаев, а при небольших, локальных аневризмах – в 10 - 30 %. При площади охваченных аневризмой рубцовых изменений более 20 % поверхности ЛЖ развивается его дилатация, приводя к срыву компенсаторной гиперфункции сохраненного миокарда и застойной сердечной недостаточности. Дилатация левого желудочка в остром периоде инфаркта миокарда может быть отнесена к компенсаторному механизму, поддерживающему КСО левого желудочка и возникающему при поражении более 20 % сердечной мышцы. Ремоделирование левого желудочка происходит неравномерно и сопровождается более выраженной дисфункцией зон, прилежащих к инфаркту, то есть при позднем постинфарктном ремоделировании в процесс вовлекается преимущественно оставшийся непораженным сократительный миокард. При мелкоочаговых инфарктах функция и геометрия желудочка могут вернуться к нормальным характеристикам в фазе восстановления, тогда как при обширных некрозах миокарда наблюдается прогресс¬сирующее ремоделирование с дополнительным увеличением объема и дальнейшим расстройством геометрии левого желудочка.
Дилатация полости левого желудочка при сниженных возможностях его сократительной способности не позволяет реализоваться компенсаторному механизму Франка Старлинга. Прогрессирующее нарушение динамического измене¬ния конфигурации левого желудочка ухудшает его диастолическое наполнение, которое становится более зависимым от растяжения и расслабления кардио¬миоцитов. Увеличение напряжения стенки дилатированного желудочка может слу¬жить стимулом для гипертрофии кардиомиоцитов, которая уменьшает миокардиальный стресс, а также для дальнейшей дилатации левого желудочка. В результате преобладания скорости дилатации над скоростью гипертрофии желудочек становится тонкостенным, нарушается его геометрия с переходом к гемодинамически невыгодной сферической форме (рис. 1). На поздних стадиях деком¬пенсации сердечной недостаточности застойного типа резкая дилатация камер сердца приводит к увеличению массы миокарда за счет повышения общего объема желудочков, а не прироста толщины их стенок, т.е. происходит миогенная дила¬тация. Для поддержания постоянного уровня артериального давления дилатированый левый желудочек должен выполнять бόльшую работу, чем недилатированный.
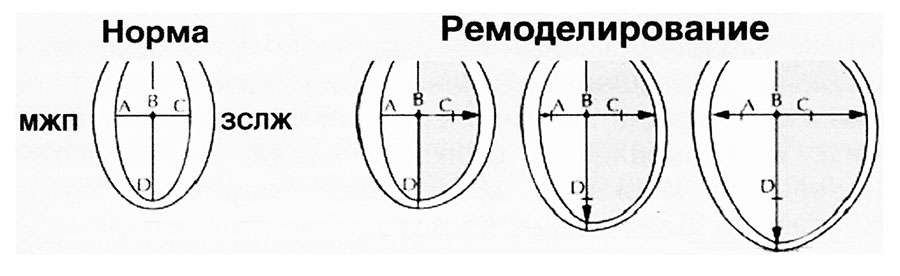
Рис. 1. Схематическая характеристика процессов постинфарктного ремоделирования, изменения архитектоники левого желудочка больше затрагивают свободную стенку левого желудочка, и меньше – межжелудочковую перегородку (по А. Abbate et al., 2003)
В то же время дилатация левого желудочка, нарушение его геометрии и резкое повышение напряжения его стенок могут определить прогрессирование сердечной недостаточности застойного типа. Существует понятие об адаптивном и дезадаптивном ремоделировании, которое отражает фазовое течение процесса компенсации геометрического и структурного изменения левого желудочка. Адаптивное ремоделирование после ОИМ проявляется тенденцией к уменьшению полости левого желудочка, сохранением цилиндрической формы левого желудочка, поддержанием его удовлетворительной сократительной способности и стабилизации миокардиального стресса. Для дезадаптивного ремоделирования характерны прогрессирующая дилатация полости левого желудочка с переходом к гемодинамически невыгодной более сферичной форме желудочка, значительная эксцентрическая гипертрофия левого желудочка, которая не предотвращает рост миокардиального стресса, постепенное снижение сократительной функции миокарда. При характеристике этапов ремоделирования следует отметить такие качества, как идентичность поздних стадий ремоделирования при разных этиологических причинах повреждения миокарда и растянутость во времени процесса ремоделирования. На определенном этапе развития сердечной декомпенсации сердце вступает в фазу «структурной кардиопатии», для которой характерны единые механизмы функционирования ремоделирования сердца, единые изменения периферического кровообращения, одинаковые изменения кардиомиоцитов и других морфологических характеристик миокарда, независимо от этиологии застойной сердечной недостаточности. Это явление получило название «кардиомиопатии перегрузки». Важная концепция, подтвержденная результатами SOLVD у больных с постинфарктным кардиосклерозом, заключается в том, что ремоделирование является прогрессирующим процессом, который начинается во время повреждения сердечной мышцы и продол¬жается даже после прекращения повреждающего действия на миокард. Растянутость во времени процесса ремоделирования левого желудочка обусловлена хронической гиперактивацией процесса аутоиммунного воспаления, а также системных и локальных миокардиальных ренин-ангиотензиновых и симпатоадреналовой систем, натрийуретических пептидов. Начавшись в остром периоде инфаркта миокарда, иммуновоспалительная и нейрогуморальная активация продолжается длительный период, первоначально направленная на компенсацию нарушений кардиогемодинамики, избыточная нейрогормональная активность усиливает кардиопролиферативные процессы и способствует прогрессированию ремоделирования миокарда. Из числа многочисленных пептидов, способствующих пролиферации кардиомиоцитов, интерстициальному фиброзу миокарда и тем самым ишемическому ремоделированию, в в изучении патогенеза застойной сердечной недостаточности были изучены про- и противовоспалительные цитокины (ФНО-a, ИЛ-1a, ИЛ-6, ИЛ-4), альдостерон, мозговой натрийуретический пептид, калликреин.
^Наверх
Полезно знать
- История изучения патогенеза хронической сердечной недостаточности (синдрома ХСН)
- Роль и значение нейрогуморальных систем в патогенезе сердечной недостаточности
- Симпатоадреналовая система (симпатическая активность, норадреналин) в патогенезе ХСН
- Активизация ренин-ангиотензин-альдостероновой системы - важное звено в патогенезе хронической сердечной недостаточности
- Роль системы натрийуретических факторов в патогенезе синдрома ХСН
- Современные принципы применение бета-адреноблокаторов в лечении пациентов с ХСН
- Ингибиторы вазопептидаз - новый класс нейрогуморальных модуляторов в лечении ХСН
- Современные подходы и средства лечения больных с хронической сердечной недостаточностью (лекарственные препараты групп ИАПФ и БРА)
- Эффективность препаратов ингибиторов АПФ (ИАПФ) в терапии пациентов больных ХСН
- Использование антагонистов к рецепторам эндотелина (бозентан, фосфорамидон, BQ-123, RES-701-1) в лечении пациентов с ХСН
- Роль блокаторов ангиотензиновых рецепторов (антагонистов к рецепторам ангиотензина II) в терапии ХСН
- Применение бета блокаторов при сердечной недостаточности (ХСН) - действие, длительный прием, особености назначения, результаты научных исследований
- История изучения патогенеза хронической сердечной недостаточности (синдрома ХСН)
- Роль и значение нейрогуморальных систем в патогенезе сердечной недостаточности
- Симпатоадреналовая система (симпатическая активность, норадреналин) в патогенезе ХСН
- Активизация ренин-ангиотензин-альдостероновой системы - важное звено в патогенезе хронической сердечной недостаточности
- Роль системы натрийуретических факторов в патогенезе синдрома ХСН
- Современные принципы применение бета-адреноблокаторов в лечении пациентов с ХСН
- Ингибиторы вазопептидаз - новый класс нейрогуморальных модуляторов в лечении ХСН
- Современные подходы и средства лечения больных с хронической сердечной недостаточностью (лекарственные препараты групп ИАПФ и БРА)
- Эффективность препаратов ингибиторов АПФ (ИАПФ) в терапии пациентов больных ХСН
- Использование антагонистов к рецепторам эндотелина (бозентан, фосфорамидон, BQ-123, RES-701-1) в лечении пациентов с ХСН
- Роль блокаторов ангиотензиновых рецепторов (антагонистов к рецепторам ангиотензина II) в терапии ХСН
- Применение бета блокаторов при сердечной недостаточности (ХСН) - действие, длительный прием, особености назначения, результаты научных исследований









