Цитокиновый шторм при хронической сердечно-сосудистой недостаточности у больных постинфарктным кардиосклерозом и ИБС без инфаркта

В работе проведено исследование провоспалительных и противовоспалительных цитокинов (цитокинового шторма ФНО-, ИЛ-1, ИЛ-4, ИЛ-6), гуморальных показа¬телей (МНП, альдостерона, калликреина), липидного спектра у больных при хронической сердечно-сосудистой недостаточности вследствие ИБС с перенесенным ОИМ и без инфаркта в анамнезе. Исследуемые показатели имеют важное значение не только в патогенезе синдрома хронической сердечно-сосудистой недостаточности, но и выполняют значительную роль в индукции гипертрофии кардиомиоцитов и интерстициального фиброза миокарда, то есть участвуют в процессе постинфарктного ремоделирования миокарда. В литературе имеются единичные указания на наличие корреляционной зависимости между цитокиновым штормом и указанными нейрогормонами при ОИМ и хронической сердечно-сосудистой недостаточности, что свидетельствует о существовании общих точек сопряжения в процессе их активации и функционирования. Выполнено сопоставление уровней иммуновоспалительных цитокинов, состояния липидного обмена, МНП, альдостерона, калликреина, эхокардиографических показателей ремоделирования миокарда у больных с постинфарктным кардиосклерозом (74 пациента) и больных ИБС без инфаркта (38 пациентов). В табл. 1. представлена клиническая характеристика больных с постинфарктным кардиосклерозом и ИБС без инфаркта, которая свидетельствует об идентичности групп срав¬нения по демографическим и клиническим показателям. При сравнении уровней про- и противовоспалительных цитокинов оказалось, что показатели цитокинового шторма - ФНО-, ИЛ 1, ИЛ-4, ИЛ-6 достоверно превышали таковые у здоровых лиц, исключение составили ИЛ-6 и ИЛ-4 у больных хронической сердечно-сосудистой недостаточностью II ФК без перенесенного инфаркта (табл. 2).
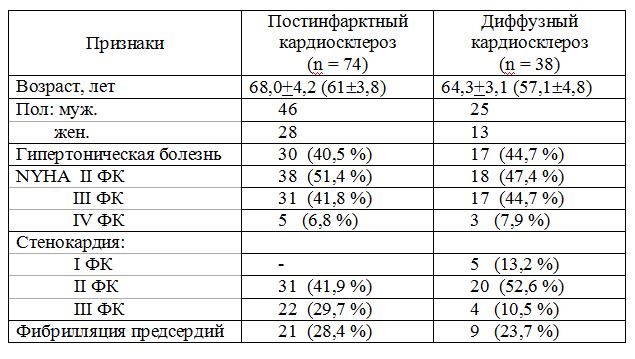
Таблица 1 - Сравнительная клиническая характеристика больных ИБС с постинфарктным и диффузным кардиосклерозом (число больных)
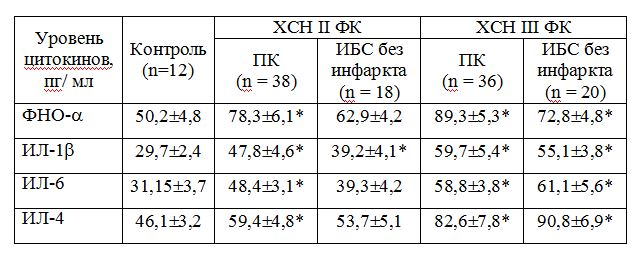
Таблица 2 - Цитокиновый шторм при хронической сердечно-сосудистой недостаточности у больных постинфарктным кардиосклерозом (ПК) и ИБС без инфаркта (Мm)
Более высокие значения цитокинового шторма определялись при хронической сердечно-сосудистой недостаточности III ФК при сравнении с ХСН II ФК: различия были достоверны у больных с постинфарктным кардиосклерозом по уровню ФНО- (р<0,05), ИЛ-6 (р<0,05), ИЛ-1 (р<0,05), ИЛ-4 (р<0,05); у больных ИБС без инфаркта – по ФНО- (р<0,05), ИЛ-1 (р<0,05), ИЛ-6 (р<0,05), ИЛ-4 (р<0,01). По данным литературы, цитокин-индуцированное нарушение сократительной способности миокарда и его ремоделирование характерно для хронической сердечно-сосудистой недостаточности любой этиологии, однако сведения об участии отдельных цитокинов (ФНО-, ИЛ 1, ИЛ-6) противоречивы. Так, установлено возникновение значительного цитокинового шторма путем увеличение уровня ФНО- при тяжелой сердечной недостаточности (III-IV ФК NYHA) по сравнению со здоровыми лицами, увеличение уровня ФНО-, ИЛ 1 и противовоспалительного цитокина ИЛ-4 при выраженной хронической сердечно-сосудистой недостаточности и отсутствие существенных изменений ИЛ-6. В других работах подтверждена тесная корреляционная связь между уровнем ФНО-, ИЛ-1, ИЛ-6 и тяжестью клинических проявлений хронической сердечно-сосудистой недостаточности и активностью гуморальной системы. В ряде исследований показано умеренное увеличение ФНО- при ХСН.
Munger et al. не обнаружили увеличения в сыворотке крови концентрации ФНО-, ИЛ-1, рИЛ-2Р, но выявили существенное повышение концентрации ИЛ-6 при хронической сердечно-сосудистой недостаточности, что может свидетельствовать о наличии цитокинового шторма. Очевидная противоречивость данных об изменении концентрации отдельных цитокинов при ХСН, вероятно, связана с особенностями местных эффектов цитокинов, которые действуют преимущественно паракринным (на окружающие клетки) и аутокринным (на продуцирующие их клетки) образом. Кроме того, существует динамический баланс между про- и противо¬воспали¬тельными цитокинами. Так, большинство про¬воспали¬тельных цитокинов иногда проявляют противо¬воспалительные свойства. Результирующий эффект любого цитокина зависит от времени его выделения, местной среды, в которой он действует, присутствия конкурентных или синергичных компонентов, плотности цитокиновых рецепторов и способности тканей отвечать на каждый цитокин. Несмотря на некоторые разногласия между степенью изменений уровней ФНО-, ИЛ-1, ИЛ-6 при ХСН, остается бесспорным факт положительной корреляции между гиперпродукцией цитокинов и степенью тяжести ХСН, подтверждающий теорию «цитокинового шторма» в патогенезе хронической сердечно-сосудистой недостаточности. Уровень цитокинов при хронической сердечно-сосудистой недостаточности, обусловленной постинфарктным кардиосклерозом, несколько отличался от такового при ИБС без инфаркта миокарда (см. табл. 2) (рис 1.).
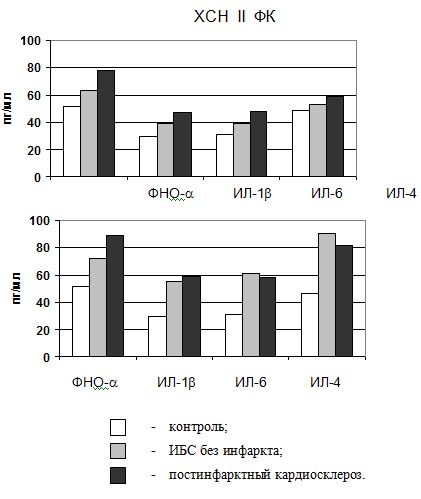
Рис. 1. Цитокиновый шторм при хронической сердечно-сосудистой недостаточности у больных постинфарктных кардиосклерозом и ИБС без инфаркта
При хронической сердечно-сосудистой недостаточности II ФК у пациентов с постинфарктным кардиосклерозом определялись достоверно более высокие значения ФНО- (р<0,05), ИЛ-1 (р<0,05), ИЛ-6 (р<0,05), чем у больных без инфаркта. Вместе с тем уровень противовоспалительного ИЛ-4, оставаясь выше контрольного значения, при сравнении групп больных ИБС в зависимости от перенесенного инфаркта практически не различался. При ХСН III ФК только уровень ФНО- у больных с постинфарктным кардиосклерозом достоверно превышал таковой в группе ИБС без инфаркта (р<0,01), значения ИЛ-1, ИЛ 6, ИЛ-4, оставаясь выше нормы, в группах больных постинфарктным и диффузным кардиосклерозом не различались. В литературе имеются единичные сообщения об феномене цитокинового шторма при постинфарктном кардиосклерозе, вместе с тем основания для увеличения цитокинообразования существуют. Известно, что ОИМ сопровождается усилением экспрессии цитокинов, однако сведения в литературе о том, какие преимущественно цитокины выделяются в избытке при ОИМ, противоречивы. Повышение содержания ИЛ-1, ИЛ-2, ИЛ-6, ИЛ-8, ФНО- отмечалось у больных ОИМ и нестабильной стенокардией прогрессирующего течения, при этом осложненное течение ОИМ (кардиогенный шок, нарастающая недостаточность кровообращения) сопровождалось дополнительным увеличением уровня цитокинов. Однако есть работы, в которых при ОИМ отмечено увеличение содержания ИЛ-6, ИЛ-1 и снижение ФНО-, ИЛ-2, ИЛ-8.
То есть при ОИМ так же, как и при хронической сердечно-сосудистой недостаточности, данные о видах цитокинового шторма противоречивы. Вместе с тем имеются все основания считать, что ОИМ «запускает» цитокиновую сеть, между составляющими которой имеются сложные взаимодействия. Дальнейшее постинфарктное ремоделирование ассоциируется со следующим этапом действия провоспалительных цитокинов – их «долговременными» эффектами, которые проявляются постепенным разрушением коллагенового матрикса миокарда, дилатацией желудочков и гипертрофией кардиомиоцитов с фор¬мирова¬нием синдрома ХСН. Эксперименталь¬ным подтвержде¬нием этого являются данные B. Borkurt et al.: при инфузии низких доз ФНО- у крыс наступал отрицательный инотропный эффект, который был полностью обратим после прекращения инфузии. В то же время влияние ФНО- на ремоделирование левого желудочка (гипертрофию кардиомиоцитов, дилатацию левого желудочка и уменьшение его толщины) не было обратимым после прекращения инфузии и сохранялось после введения ингибиторов ФНО-, что позволило предположить ФНО--индуцированное разрушение фибриллярного коллагенового матрикса. В эксперименте наблюдение за экспрессией мРНК ФНО-, ИЛ-1, ИЛ-6 в инфарцированном и неинфарцированном миокарде показало, что при ОИМ экспрессия генов этих цитокинов увеличивается в зоне инфаркта, после перенесенного инфаркта экспрессия генов этих цитокинов была значительно выше в неинфарцированной зоне. Следовательно, вызванная перенесенным инфарктом миокарда активация цитокинового каскада на фоне ишемической кардиопатии вносит существенный вклад в развитие постинфарктного ремоделирования и хронической сердечно-сосудистой недостаточности. Обращают внимание более высокие значения ФНО-, ИЛ1 и ИЛ-6 при ХСН II ФК у больных с постинфарктным кардиосклерозом в сравнении с ИБС без инфаркта, в то время как при ХСН III ФК такое отличие сохранялось только в отношении ФНО-. Этот факт, вероятно, объясняется динамикой процесса постинфарктного ремоделирования, что связано с цитокиновым штормом. Несомненно, при ХСН III ФК в сравнении с хронической сердечно-сосудистой недостаточностью II ФК происходят более существенные нарушения геометрии, структуры и функции миокарда. Известна концепция, согласно которой ремоделирование является прогрессирующим процессом, не обязательно связанным с его первопричиной. Этот процесс начинается непосредственно во время повреждения сердечной мышцы, в частности ОИМ, и продолжается после прекращения повреждающего действия на миокард. Можно полагать, что при ХСН II ФК после перенесенного инфаркта преобладает миокардиальная гиперпродукция ФНО-, ИЛ-1, ИЛ-6, которая участвует в инициации процесса постинфарктного ремоделирования и развития хронической сердечно-сосудистой недостаточности . При ХСН III ФК сердце вступает в фазу «структурной кардиомиопатии», для которой характерны единые механизмы ремоделирования миокарда, обусловленные постинфарктным кардиосклерозом и ИБС без инфаркта, в связи с этим уровни ИЛ-1 и ИЛ-6 остаются высокими, но различия между группами сравнения исчезают. Увеличение уровня ФНО-, которое определено при хронической сердечно-сосудистой недостаточности III с постинфарктным кардиосклерозом, может быть связано как с особенностями миокардиальной гиперпродукции, так и с увеличением его экстрамиокардиальной гиперпродукции в легких, кишечнике, мышцах и других тканях, характерной для гипоксии периферических тканей, формировании феномена цитокинового шторма. Определенный интерес представляет изучение при постинфарктном кардиосклерозе связи биохимических маркеров атеросклеротического процесса и показателей усиления экспрессии цитокинов.
Продукция провоспалительных цитокинов активированными лейкоцитами в «ранимой» атеросклеротической бляшке причастна к возникновению инфаркта миокарда, поскольку цитокины усиливают протромбогенную и вазоконстрикторную активность эндотелия, стимулируют экспрессию адгезивных молекул для активированных лейкоцитов и тромбоцитов, вызывают инфильтрацию сосудистой стенки воспалительными клетками. Найдена корреляция между уровнями ФНО-, ИЛ-1, ИЛ-6 и тяжестью коронарной болезни сердца, в том числе выраженностью коронаросклероза по данным коронарографии. Особое значение придается способности ФНО- вызывать клеточный некроз и ускорять пристеночное тромбообразование с формированием осложненных атеросклеротических бляшек.
Статья посвящена цитокиновому шторму при хронической сердечно-сосудистой недостаточности у больных постинфарктным кардиосклерозом и ИБС без инфаркта.
^Наверх









