Систолическая экскурсия митральной и трикуспидальной кольцевой плоскости у кошек с гипертрофической кардиомиопатией

Spalla I., Payne J.R., Borgeat K., A. Pope, Luis Fuentes V., Connolly D.J. Mitral Annular Plane Systolic Excursion and Tricuspid Annular Plane Systolic Excursion in Cats with Hypertrophic Cardiomyopathy // J Vet Intern Med. 2017; 31(3): 691–699.
Систолическая экскурсия митральной и трикуспидальной кольцевой плоскости у кошек с гипертрофической кардиомиопатией
Абстракт
Фон. Систолическая дисфункция левого желудочка (ЛЖ) связана с повышенным риском смерти у кошек с гипертрофической кардиомиопатией (HCM). Митральная и трикуспидальная систолическая экскурсия в кольцевой плоскости (MAPSE и TAPSE, соответственно) являются мерами продольной систолической функции и снижаются у пациентов с HCM.
Гипотезы. Кошки с HCM имеют более низкие MAPSE и TAPSE по сравнению с контрольными кошками; более низкие MAPSE и TAPSE связаны с наличием застойной сердечной недостаточности (CHF) и сокращением времени выживания.
Животные. 64 кошки с HCM и 27 здоровых кошек. Сорок пять кошек с HCM не показывали клинических признаков, а 19 имели CHF.
Методы. Ретроспективное исследование. Анатомический М-режим из левого апикального 4-камерного вида использовался для записи MAPSE со свободной стенки (MAPSE FW) и перегородки (MAPSE IVS) и TAPSE.
Результаты. По сравнению с контролем у кошек с HCM был более низкий MAPSE IVS (контроль 5.2 [4.6-5.6] мм, при бессимптомной HCM 4.7 [4.1-5.2] мм, HCM с CHF 2.6 [2.5-3.2] мм, P <.001), MAPSE FW (контроль 5,9 [5,3-6,2] мм, асимптоматической HCM 4,7 [4,1-5,1] мм, НСМ с CHF 2,8 [2,4-3,2] мм) и TAPSE (контроль 8,6 [7,4-10,2] мм, бессимптомной HCM 7.2 [6.3-8.2 ] мм, HCM с CHF 4.6 [4.1-5.4] мм), с наименьшим значением в CHF-группе. Одномерный анализ выживаемости показал более короткую выживаемость у кошек, демонстрирующих более низкие MAPSE IVS, MAPSE FW и TAPSE.
Выводы и клиническое значение. MAPSE и TAPSE были ниже у кошек с HCM, чем у контрольных кошек и были самыми низкими при CHF, что указывает на систолическую продольную дисфункцию у кошек с HCM. MAPSE и TAPSE имеют потенциальное прогностическое значение.
Ключевые слова: эхокардиография, кошка, гипертрофическая кардиомиопатия
ГКМП у кошек - актуальная проблема в ветеринарной кардиологии.
Сокращения
- LA / Ao - отношение левого предсердия к аортальному корню
- LAD диаметр левого предсердия по длинной оси
- LAFS левопредсердная фракция укорочения
- LVFS левожелудочковое фракция укорочения
- Систолическая экскурсия по митральной кольцевой плоскости MAPSE
- S0 FW ткань Doppler-полученная S0-волна в левом желудочке
- свободная стена
- S0 IVS ткань Доплеровская S0-волна на межжелудочковой перегородке
- Систолическая экскурсия в трехсторонней кольцевой плоскости TAPSE
Гипертрофическая кардиомиопатия (HCM) является наиболее распространенной сердечной болезнью у кошек [1, 2]. Она характеризуется гипертрофированным левым желудочком при отсутствии других сердечно-сосудистых или системных причин [3]. Недавно сообщалось, что увеличение толщины стенки правого желудочка является типичным для кошек с HCM и связаны с тяжестью гипертрофии левого желудочка [4]. Кошки с HCM могут иметь переменную продолжительность жизни; несколько клинических и эхокардиографических прогностических факторов, в том числе размер и функцию левого предсердия (ЛА), гипертрофию левого желудочка, показатели систолической и диастолической дисфункции левого желудочка, наличие застойной сердечной недостаточности и тромбоэмболии аорты, что было связано с уменьшением выживаемости у кошек с HCM [5, 6, 7, 8, 9].
Систолическая экскурсия по митральной кольцевой плоскости (MAPSE) и двусторонняя систолическая экскурсия по трикуспидальной кольцевой плоскости (TAPSE) являются показателями M -модального систолического продольного смещения атриовентрикулярной кольцевой плоскости [10, 11]. MAPSE и TAPSE могут поэтому рассматриваться как маркеры длинноосевой функции левого желудочка (LV) [10, 12] и правого желудочка (RV) [11, 13] соответственно. Однако признано, что левосторонняя сердечная болезнь также может влиять на TAPSE [14, 15].
В настоящее время нет никаких опубликованных эталонных значений для MAPSE и TAPSE у кошек и нет информации об их потенциальной диагностической и прогностической полезности при HCM.
Цели исследования
Предоставить предварительные контрольные интервалы для MAPSE и TAPSE у здоровых кошек.
Чтобы определить, имеют ли кошки с HCM более низкие значения MAPSE и TAPSE по сравнению с контрольными кошками и связаны ли нижние MAPSE и TAPSE с присутствием CHF.
Чтобы выяснить, имеют ли более низкие значения MAPSE или TAPSE прогностическую ценность у кошек с HCM.
Материалы и методы
Ретроспективное исследование. Электронный отчет пациентов относительно клиники королевы-матери для животных (QMHA) был рассмотрен для кошек с диагнозом HCM в период с апреля 2013 года по сентябрь 2015 года. Контрольная группа включала здоровых кошек, проходящих кардиальную оценку в рамках программы доноров крови.
Чтобы быть включенными в исследование, потребовался полный отчет о болезни (данные о владельцах, сигнатура кота / донора и история, полное физическое обследование и текущие лекарства) и полное эхокардиографическое обследование. Дополнительным критерием включения был левый апикальный 4-камерный кинопетля адекватного качества для измерения MAPSE и TAPSE.
Критерии исключения включали кошек с диагнозом других состояний, которые могли влиять на толщину стенки ЛЖ, такие как гипертиреоз, системная гипертензия, акромегалия, кардиомиопатии, отличные от HCM, врожденные пороки сердца или опухолевые заболевания или с неполным регистрационным случаем или эхокардиографическим исследованием.
Полное стандартное эхокардиографическое исследование, включающее M-режим, B-режим и допплеровскую эхокардиографию, было выполнено у всех кошек в соответствии с опубликованными человеческими и ветеринарными руководящими принципами для медицины людей и ветеринаров [11, 16].
У кошек был диагностирован HCM, когда конечная диастолическая толщина стенки левого желудочка, измеренная в B-режиме, была равна или больше 6 мм. Кроме того, размер и функцию ЛЖ оценивали путем измерения отношения левого предсердия к аорте (LA / Ao) в начале QRS [8, 17], диаметра левого предсердия по длинной оси (LAD) [8, 17], измеренного в конце систолы и его фракцию укорочения (LAFS) [8]. Систолическая функция левого желудочка была оценена фракцией укорочения левого желудочка (LVFS) в M-режиме [8]. Там, где это возможно, S-волна межжелудочковой перегородки (S 'IVS) и свободной стенки желудочка ( S 'FW) измеряли от митрально- кольцевой перегородки и допплеровской визуализации свободной стенки (TDI) соответственно [11, 12, 18].
Кошки с HCM были классифицированы как бессимптомные, если они не получали никаких сердечных препаратов и не имели признаков или истории увеличения частоты дыхания, одышки, обморока или системной тромбоэмболии.
Чтобы быть включенным в группу CHF, кошки должны были иметь увеличенную частоту дыхания, аномальную торакальную аускультацию и свидетельство отека легких или плеврального выпота путем визуализации (либо торакального ультразвука, либо торакальной радиографии) во время презентации в QMHA. Полное эхокардиографическое обследование происходило не позднее, чем через 24 часа после поступления и стабилизации, когда это было необходимо. Все эхокардиографические исследования проводились ветеринарным кардиологом или резидентным врачом, который контролировался специалистом-кардиологом.
Офлайновые измерения MAPSE и TAPSE выполнялись с помощью анатомического M-режима (1) из левой апикальной 4-камерной проекции, как описано в руководящих принципах у собак и человека [10, 11, 12, 19, 20]. Вкратце, анатомический курсор M-режима был выровнен параллельно с межжелудочковой перегородкой (для MAPSE IVS), свободной стенкой (для MAPSE FW) или свободной желудочковой стеной (для TAPSE), и была получена трассировка M-режима. Как MAPSE, так и TAPSE измерялись в мм с помощью электронных суппортов между самым базовым положением трикуспидного кольца в концевой диастолы и его наиболее вершинным смещением в конце систолы методом передней кромки (рис. 1). Все измерения TAPSE и MAPSE выполнялись одним наблюдателем (IS). Было проведено пять последовательных измерений, и результаты были усреднены. Внутри- и межисследовательская изменчивость для получения анатомического изображения M-режима и последующего измерения оценивалась в случайно выбранных 10% популяции. Измерения для повторяемости внутрипоследовательности выполнялись одним наблюдателем (ИС) в 2 раза с 1 неделей друг от друга. Измерения повторяемости наблюдались независимо двумя наблюдателями (IS и JRP).
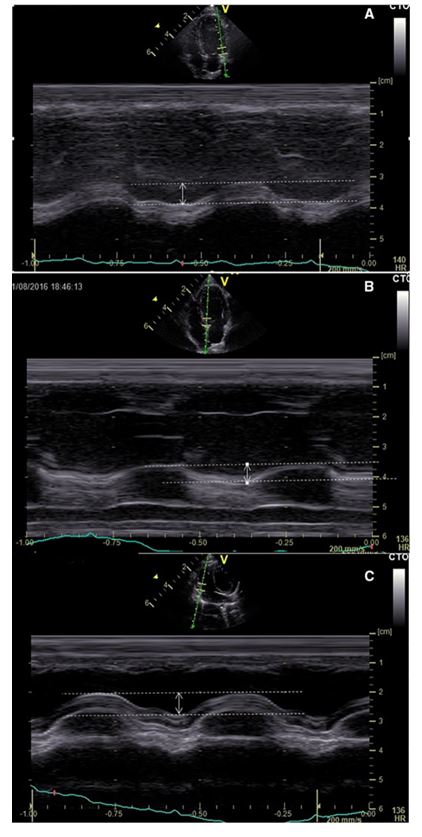
Рисунок 1 - Техника получения и измерения MAPSE и TAPSE с помощью M-режима из 4-камерного левого апикала. Подробности см. в тексте.
Информация о выживании кошек с диагнозом HCM была получена путем изучения электронного клинического архива и обращения к ветеринарам. Смертность от всех причин была конечной точкой в анализе выживаемости. Кошки, все еще живые, подвергались цензурированию в статистическом анализе; испытуемые, потерянные для наблюдения, были включены в анализ выживания до последнего момента, когда они были известны как живые, а затем подвергались цензурированию в анализе.
Статистический анализ
Статистический анализ выполнялся коммерчески доступным статистическим программным обеспечением (2), и во всех случаях статистическая значимость была установлена при P <0,05. Тест Шапиро-Вилка использовался для проверки нормального распределения переменных. Ненормальные по распределению данные приведены как медиана (интерквартильный диапазон, IQR1-3, от 25-го процентиля до 75-го процентиля).
Тест Mann-Whitney U или Kruskal-Wallis использовался для сравнения, по мере необходимости, упорядоченных и непрерывных нерегулируемых распределенных данных. Последовательные сравнения выполнялись методом Данна.
Для исследования повторяемости были рассчитаны коэффициенты вариации (CV) внутри- и межисследовательской ошибки были получены графики Бланда-Альтмана.
Исходные интервалы были рассчитаны на основе доверительных интервалов 90%, как рекомендовано для нормально распределенных популяций с 20-40 особями графики Бланда-Альтмана [21].
Выживание было рассчитано как дни между диагнозом и смертью или последним посещением. Метод Каплана-Мейера использовался для оценки функции выживания и графика времени для кривых событий в разных группах. Непрерывные переменные изучались путем деления на группы, основанные на третичных. Тест лог-ранга с правильной цензурой использовался для определения того, существует ли существенная разница между группами.
Результаты
С апреля 2013 года по сентябрь 2015 года 100 кошек были диагностированы с гипертрофией левого желудочка. После исключения для одновременного системного заболевания (n = 22) в исследование было включено при отсутствии подходящей 4-камерной апикальной кинопетли (n = 8) или обоих (n = 6), 64 кошек с HCM. Из этих 64 кошек 45 были бессимптомными, а 19 имели ЗСН. Контрольная группа включала 27 здоровых кошек-доноров крови.
Средний возраст выборки составил 5,6 (3,8-7,0) года, а средний вес тела составлял 4,6 (4,2-5,0) кг. Было 56 мужчин и 35 женщин. Большинство кошек были домашними короткошерстными (n = 61), а затем бенгалами (n = 6), персами (n = 6) и домашними длинношерстными (n = 5). Другие породы включали британские короткошерстные и регдолы (n = 3), мейн-куны, шотландскую и бирманскую породу (n = 2), селкикрекс (n = 1).
Для здоровых контрольных кошек были созданы контрольные интервалы (таблица 1).
Таблица 1 - Распределение данных для MAPSE и TAPSE у 27 здоровых кошек
| MAPSE FW | MAPSE IVS | TAPSE | |
| M (mm) | 5.89 | 5.22 | 9.02 |
| Стандартное отклонение | 0.65 | 0.59 | 2.18 |
| Референсный интервал (90% доверительный интервал) | 5.67–6.12 | 5.02–5.43 | 8.27–9.77 |
| Минимум | 4.90 | 4.20 | 5.20 |
| Максимум | 7.30 | 6.30 | 13.40 |
Не было существенной разницы между контролем и кошками с HCM в отношении возраста (P = 0,15), пола (P = 0,45), массы тела (P = 0,46) или LVFS (P = 0,45). Кошки с HCM имели больший LAD (P <.001) и LA / Ao (P <0,001), чем контрольные кошки. Кошки с HCM имели более низкие LAFS (P <.001), TAPSE (P <.001), MAPSE IVS (P <.001), MAPSE FW (P <.001), S 'IVS (P = 0,37) и S 'FW (P <.001), чем контрольные (Таблица 2).
Таблица 2 - Характеристики выборки и эхокардиографические данные у 91 кошки, включенных в исследование. Данные представлены как медиана (IQR1-3). Статистический анализ указывает на статистически значимое различие в группах, основанных на постхок-анализе. α = нормальный vs HCM бессимптомный; β = нормальный vs HCM с CHF; γ = HCM бессимптомный против HCM с CHF. Жирные значения показывают статистически значимые результаты
| Клинически здоровые | ГКМП | P value (Normal vs HCM) | Бессимптомная HCM | HCM с CHF | Достоверность разницы (здоровые vs бессимптомные HCM vs HCM с CHF) | |
| Возраст (годы) | 4.8 (2–7.9) | 5.2 (3–8.9) | P = .15 | 5.8 (3.7–8.2) | 6.0 (3.3–8.8) | P = .30 |
| Пол | 15♂ 12♀ |
41♂
23♀ |
P = .45 | 30♂ 15♀ |
11♂ 8♀ |
P = .55 |
| Порода | 18 DSH, 2 DLH, 2 Maine Coon, 1 each Ragdoll, Bengal, Persian, BSH, Selkirk Rex | 43 DSH, 5 Persian, 5 Bengal, 3 DLH, 2 Birman, 2 Ragdoll, 2 BSH, 2 Scottish fold | 31 DSH, 4 Bengal, 3 DLH, 3 Persian, 1 each Ragdoll, Birman, BSH, Scottish fold | 12 DSH, 2 Persian, 1 each Bengal, Birman, Ragdoll, Scottish Fold and BSH | ||
| Вес (кг) | 4.3 (3.7–5.2) | 4.6 (3.9–5.2) | P = .46 | 4.7 (4.0–5.3) | 4.2 (3.7–5.1) | P = .49 |
| ЧСС (уд\мин) | 176 (161–211) | 184 (158–200) | P = .79 | 175 (158–193) | 200 (187–211) | P = .09 |
| LAD (мм) | 14.3αβ (13.0–15.3) | 16.5 (14.4–19.5) | P < .001 | 16.0αγ (14.1–17.9) | 19.9βγ (16.2–22.6) | P < .001 |
| LA/Ao соотношение | 1.27αβ (1.12–1.36) | 1.51 (1.35–2.03) | P < .001 | 1.39αγ (1.28–1.60) | 2.10βγ (1.80–2.39) | P < .001 |
| LAFS (%) | 33.4β (28.9–36.9) | 23.9 (16.8–30.5) | P < .001 | 26.6 (22.4–32.7) | 13.3β (7.6–20.3) | P < .001 |
| LVFS (%) | 49.5 (45.1–53.5) | 47.5 (41.2–59.2) | P = .45 | 57.0 (43.1–61.9) | 44.8 (38.3–56.7) | P = .07 |
| TAPSE (мм) | 8.6αβ (7.4–10.2) | 6.7 (4.7–7.6) | P < .001 | 7.2α (6.3–8.2) | 4.6βγ (4.1–5.4) | P < .001 |
| MAPSE IVS (мм) | 5.2αβ (4.6‐5.6) | 4.3 (2.9‐5.0) | P < .001 | 4.7αγ (4.1–5.2) | 2.6β (2.5–3.2) | P < .001 |
| MAPSE FW (мм) | 5.9αβ (5.3‐6.2) | 4.6 (3.0‐4.9) | P < .001 | 4.7αγ (4.1–5.1) | 2.8βγ (2.4–3.2) | P < .001 |
| S′ IVS (cм/с) | 9.0β (8.0–10.1) | 8.1 (6.1‐10.0) | P = .04 | 8.2γ (7.1–10.2) | 6.0βγ (5.0–6.3) | P < .001 |
| S′ FW (cм/с) | 8.5αβ (7.4–10.6) | 5.2 (4.4–7.1) | P < .001 | 6.2αγ (5.0–7.6) | 4.4βγ (4.0–5.0) | P < .001 |
При сравнении контрольных кошек, бессимптомных кошек с HCM и кошек с HCM и CHF, кошки с HCM и CHF имели значительно меньшие MAPSE IVS, MAPSE FW и TAPSE, чем бессимптомные кошки с HCM (P <0,001, P <0,001 и P <.001 соответственно) и значительно ниже MAPSE IVS, MAPSE FW и TAPSE (P <.001, P <.001 и P <.001 соответственно), чем здоровые контрольные кошки. Бессимптомные кошки с HCM имели значительно более низкий MAPSE IVS (P <0,001), MAPSE FW (P <0,001) и TAPSE (P <0,001) по сравнению с здоровыми контрольными кошками (рис. 2, 3, 4, таблица 2).
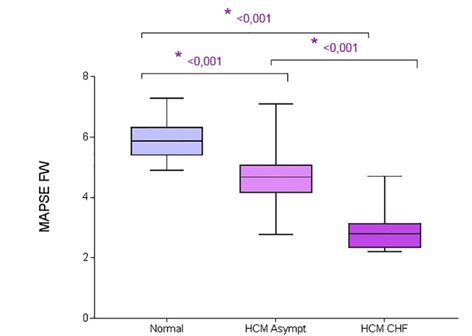
Рис 2 - Диаграмма размаха для MAPSE FW у контрольных кошек, бессимптомных кошек с HCM и кошек с HCM и CHF.
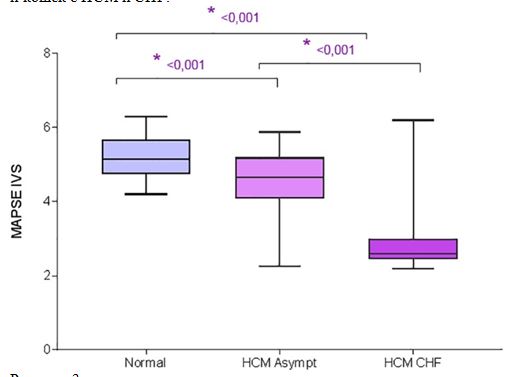
Рисунок 3 - Диаграмма размаха для MAPSE IVS у контрольных кошек, бессимптомных кошек с HCM и кошек с HCM и CHF.
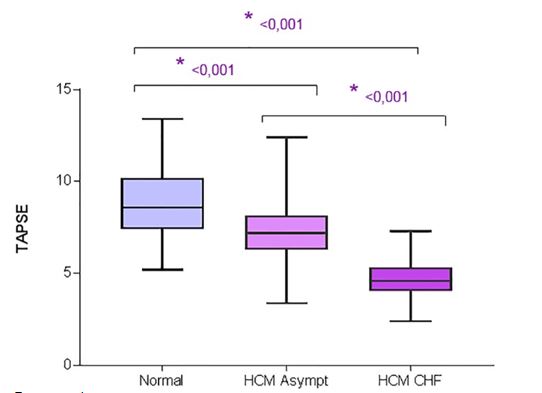
Рисунок 4 - Диаграмма размаха для TAPSE у контрольных кошек, бессимптомных кошек с HCM и кошек с HCM и CHF.
В конце периода исследования 38 из 64 кошек с HCM были все еще живы, 6 были потеряны для наблюдения, а 20 умерли. На одномерном уровне увеличились LAD и LA / Ao, а также уменьшены LAFS, MAPSE IVS, MAPSE FW и TAPSE (таблица 3, рис. 4, 5, 6, 7) были связаны со снижением времени выживания.
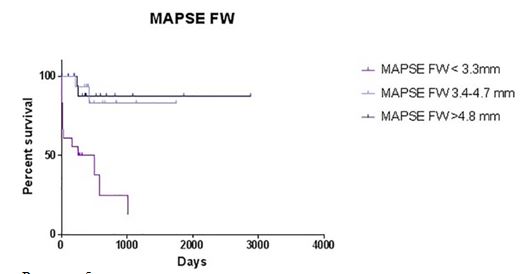
Рисунок 5 - Кривая выживаемости Kaplan-Meier для MAPSE FW. Тест на ранжирование, P <.001.
Среднее время выживания для MAPSE FW менее 3,3 мм составляет 255 дней (0-1016 дней); для MAPSE FW 3,4-4,7 мм, медианное время выживания составляет до 1748 дней (0-1748 дней); для MAPSE FW более 4,8 мм, медианное время выживания составляет до 2884 дня (0-2884 дня).
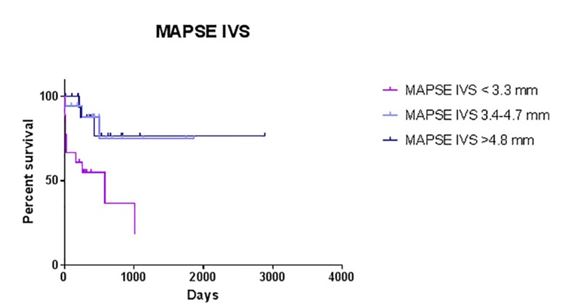
Рисунок 7 - Кривая выживания Каплана-Мейера. Тест на ранжирование, значение P <.001.
Среднее время выживания для TAPSE I менее 5,3 мм составляет 500 дней (0-1016 дней); для TAPSE 5,4-7,2 мм, медианное время выживания составляет до 1086 дней (0-1086 дней); и для TAPSE более 7,3 мм медианное время выживания составляет до 2884 дня (0-2884 дня).
Таблица 3. Анализ одноуровневой выживаемости. Отображаются медианное время выживания (MST) и диапазоны. Жирные значения показывают статистически значимые результаты
| Показатель | Тертили | Медиана времени выживания | P value |
| LAD | <15.1 mm | >2884 day (0–2884 day) | <.001 |
| 15.1–18.8 mm | >1748 day (0–1748 day) | ||
| >18.8 mm | 257 day (0–1865 day) | ||
| LA/Ao | <1.4 mm | >1748 day (0–1748 day) | <.001 |
| 1.4–1.9 mm | >2884 day (0–2884 day) | ||
| >1.9 mm | 500 day (0–1865 day) | ||
| LAFS | <20.2% | 160 day (0–500 day) | <.001 |
| 20.2–27.3% | 208 day (12–1014 day) | ||
| >27.3% | >2884 day (0–2884 day) | ||
| LVFS | <44.0% | 500 day (0–1086 day) | .093 |
| 44–58.4% | >2884 day (0–2884 day) | ||
| >58.4% | 1014 day (0–1139 day) | ||
| MAPSE FW | <3.3 mm | 255 day (0–1016 day) | <.001 |
| 3.3–4.8 mm | >1748 day (0–1748 day) | ||
| >4.8 mm | >2884 day (0–2884 day) | ||
| MAPSE IVS | <3.3 mm | 580 day (0–1016 day) | .002 |
| 3.3–4.7 mm | >1865 day (0–1865 day) | ||
| >4.7 mm | >2884 day (0–2884 day) | ||
| TAPSE | <5.3 mm | 500 day (0–1016 day) | <.001 |
| 5.3–7.2 | <>1086 day (0–1086 day) /td> | ||
| >7.2 | >2884 day (0–2884 day) | ||
| S′ FW | <4.6 | 1014 day (0–1865 day) | .167 |
| 4.6–6.5 | >1139 day (0–1139 day) | ||
| >6.5 | >2884 day (0–2884 day) | ||
| S′ IVS | <6.0 | >1865 day (12–1865 day) | .110 |
| 6.0–9.0 | >1748 day (0–1748 day) | ||
| >9.0 | >2884 day (0–2884 day) |
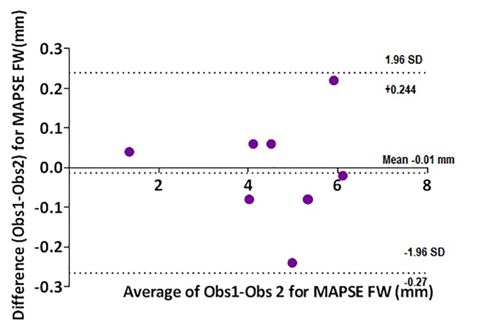
Рисунок 8 - Диаграмм Bland-Altman для MAPSE FW. Среднее смещение -0,01 (-0,27-0,244) мм.
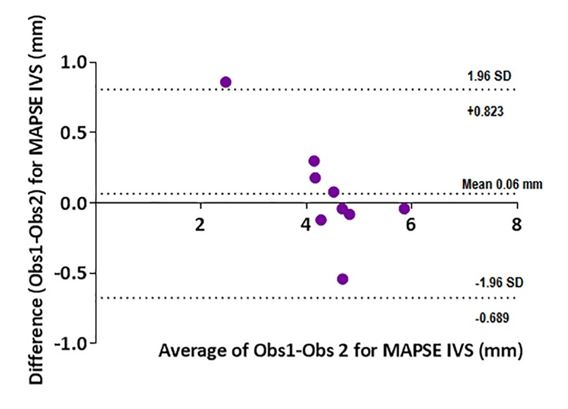
Рисунок 9 - Диаграмма Bland-Altman для MAPSE IVS. Среднее смещение 0,06 (-0,69-0,82) мм.
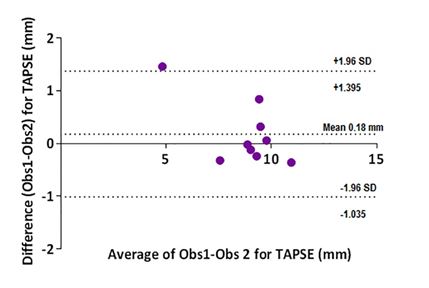
Рисунок 10 - Диаграмм Блэнд-Альтман для TAPSE. Среднее смещение 0,18 (от 1,04 до 1,40) мм.
Таблица 4 - Внутри- и межисследовательская CV для MAPSE и TAPSE
| CV | Внутриисследовательская (1) (%) | Межисследовательская CV (%) |
| MAPSE FW | 2.0 | 8.0 |
| MAPSE IVS | 1.6 | 8.0 |
| TAPSE | 1.5 | 5.0 |
Обсуждение
Результаты нашего исследования показали, что кошки с HCM имеют более низкие значения MAPSE и TAPSE по сравнению с здоровыми контрольными кошками. Кроме того, кошки с ЗСН показали самые низкие значения MAPSE и TAPSE. Хотя количество кошек в анализе было небольшим, более низкие MAPSE и TAPSE также были связаны со снижением времени выживания для смертности от всех причин, что указывает на потенциальную прогностическую ценность. Дальнейшие исследования с большим количеством кошек должны дать более высокую оценку прогностической полезности MAPSE и TAPSE в отношение смертности от сердечно-сосудистых заболеваний и всех причин. Внутреннее и межисследовательская CV, а также границы соглашения Бланда-Альтмана показали, что эта техника легко достижима и повторяема среди разных наблюдателей.
Укорочение левого желудочка по продольной оси является одним из основных компонентов сердечного сокращения, когда основание сердца смещается к его вершине. MAPSE и TAPSE измеряют продольное смещение кольцевой плоскости во время сердечного цикла и поэтому могут рассматриваться как маркеры систолической длинноосевой функции. Было подсчитано, что вклад продольного сокращения, оцененный при перемещении атриовентрикулярной плоскости, составляет до 60% от общего объема сердечного удара у здоровых взрослых людей [22]. Уменьшение продольной функции было выявлено с помощью спекл-трековой эхокардиографии в ранние стадии HCM у людей [23, 24]. Кроме того, MAPSE, измеренный с помощью МРТ, снижается у людей с обструктивной и непроизводительной HCM и коррелирует с наличием фиброза, который оценивается поздним улучшением гадолиния [25].
Точно так же результаты нашего исследования показывают, что кошки с HCM имеют более низкую MAPSE по сравнению с нормальными кошками, что подтверждает снижение систолической продольной функции даже у тех кошек, которые не показывают клинических признаков. Это аналогично выводам в медицине человека [23, 24].
Функциональные аномалии левого желудочка можно ожидать у кошек с HCM, но наше исследование показало, что продольное смещение RV также снижается у кошек с HCM. Это сравнивает результаты у людей с HCM, где было зарегистрировано снижение TAPSE [15]. Неясно, можно ли объяснить снижение TAPSE сопутствующей кардиомиопатией правого желудочка, которая была идентифицирована у одной трети пациентов и около половины из кошек с HCM [4, 26]. Альтернативно, левосторонняя сердечная недостаточность может спровоцировать дисфункцию правого желудочка через ряд патофизиологических механизмов, включая развитие легочной гипертензии [27, 28], снижение соответствия правого желудочка из-за вентрикулярной взаимозависимости [15, 28], или причины вредные изменения в перфузионном давлении коронарного давления в правом желудочке. Один или несколько из этих механизмов могут объяснить сокращение TAPSE, указанное в этом исследовании [12, 15, 27, 28].
В этом отчете кошки с ХСН имели самые низкие значения для MAPSE и TAPSE, что, вероятно, отражает прогрессирование заболевания и ухудшение систолической дисфункции. Аналогичный вывод был сообщен для LVFS у кошек с более развитой болезнью [8, 9].
Кроме того, кошки в самом низком тертиле для каждого из MAPSE IVS, MAPSE FW и TAPSE с большей вероятностью достигли конечной точки смертности от всех причин, предполагая, что эти эхокардиографические параметры имеют потенциальную прогностическую ценность. Было показано, что размер и функция левого предсердия имеют прогностическое значение у нашей выборки, как это было указано в предыдущих исследованиях [6, 7, 8, 9].
Из-за небольшого числа событий невозможно было оценить прогностическую полезность этих переменных для сердечной смертности, и было слишком мало событий для проведения многофакторного анализа для окончательной модели выживаемости. Тем не менее, эти предварительные выводы обнадеживают и согласуются с недавним исследованием, которое показало, что дисфункция правого желудочка на основе TAPSE независимо связана с повышенной вероятностью смерти или трансплантации [15] и, следовательно, требует дальнейшего изучения с большим количеством кошек.
Оба MAPSE и TAPSE - это методы, которые не требуют специальной экспертизы или передовых методов эхокардиографической визуализации, и их легко получить и измерить после минимальной подготовки [10]. Эти методы имеют дополнительное преимущество в том, что не существует значительного отрицательного эффекта апикального переднего укорочения, поскольку измерения взяты в плоскости АВ. Существуют более современные методы оценки продольной функции, такие как тканевая доплеровская визуализация (TDI) или эхокардиография с пятнистостью (STE), но для них требуется более совершенное и более дорогостоящее программное обеспечение, как правило, низкие частоты сердечных сокращений, высокая частота кадров и адекватное качество изображения. Они также связаны с более крутой кривой обучения [10].
По мнению авторов, для кошек не было опубликовано никаких справочных интервалов MAPSE и TAPSE. У собак было установлено криволинейное соотношение между TAPSE и весом, которое стало линейным, когда вес нормализовался до шкалы 1 / 3,19. Кошки могут изменяться по весу, но это, как правило, менее выражено по сравнению с собаками, где вес тела имеет существенное зависящая от породы вариация; однако, поскольку стандартные эхокардиографические параметры варьируются в зависимости от массы тела, [29] авторы рекомендуют, чтобы предварительные значения MAPSE и TAPSE, представленные в этом исследовании, применимы у кошек с массой тела от 3,7 до 5,2 кг. Дальнейшие исследования необходимы для определения степени вариации MAPSE и TAPSE на основе различий в отношении веса и породы у кошек. Настоящее исследование имеет некоторые ограничения. Прежде всего, будучи ретроспективным исследованием, было невозможно измерить TAPSE с левого апикального зрения, оптимизированного для правого желудочка во всех случаях. Как и при всех методах, требующих хорошего выравнивания, измерение MAPSE и TAPSE может быть затруднено степенью несогласованности; однако мы смогли свести к минимуму это с помощью анатомического М-режима, который позволил нам достичь приемлемого внутри- и межисследовательской CV. Однако дальнейшая валидация текущей изменчивости этих индексов продольных функций оправдана для дальнейшей оценки их точности и воспроизводимости в проспективных исследованиях. Это исследование не пыталось установить корреляции между MAPSE, TAPSE и другими эхокардиографическими показателями тяжести заболевания, такими как размер предсердий и желудочков, а также данные о функции или инвазивной катетеризации, например, для определения наличия и тяжести легочной гипертензии. Интересно, что у пациентов с HCM было показано, что дисфункция правого желудочка, измеренная TAPSE, независимо связана со степенью диастолической и систолической дисфункции левого желудочка и легочной гипертензии [15]. Кроме того, мы не оценивали влияние таких лекарств, как фуросемид на эхокардиографические параметры, которые путем уменьшения преднагрузки могут влиять на продольную функцию. Из-за небольшого числа событий мы не смогли выполнить многофакторный анализ выживаемости и необходимы дальнейшие исследования для подтверждения наших предварительных результатов выживания и оценки того, имеют ли MAPSE и TAPSE прогностическую ценность сердечной смертности. Авторы пытались исключить все возможные вторичные причины гипертрофии левого желудочка на основе имеющихся данных для каждого случая. Однако из-за ретроспективного характера исследования и проблем, связанных с окончательным подтверждением миокардита, мы не можем полностью исключить возможность того, что в исследование были включены кошки с редкими причинами LVH, такие как преходящий миокардит. Наконец, из-за ретроспективного характера исследования невозможно было ослепить исследователя, выполняющего эхокардиографические измерения, до постановки клинического диагноза кошек, что, возможно, внесло смещение в наши результаты. В заключение, у кошек с HCM был более низкий MAPSE IVS, MAPSE FW и TAPSE, с самыми низкими значениями у кошек с CHF. Кроме того, наши предварительные данные показали, что кошки с MAPSE ниже 3,3 мм и TAPSE менее 5,3 мм имели низкое время выживания. Важно отметить, что метод был признан выполнимым у большинства кошек с приемлемым внутри- и межисследовательской CV.
Ссылки
- 1Vivid 7 with Echo Pac off‐line measurement software, GE systems, Hatfield, UK
- 2IBM® SPSS® Statistics version 22, IBM (UK) Ltd, Portsmouth, UK
Статья опубликована
Spalla I., Payne J.R., Borgeat K., A. Pope, Luis Fuentes V., Connolly D.J. Mitral Annular Plane Systolic Excursion and Tricuspid Annular Plane Systolic Excursion in Cats with Hypertrophic Cardiomyopathy // J Vet Intern Med. 2017; 31(3): 691–699.
Литература
- Ferasin L, Sturgess CP, Cannon MJ, et al. Feline idiopathic cardiomyopathy: A retrospective study of 106 cats (1994–2001). J Feline Med Surg 2003;5:151–159.
- Payne JR, Brodbelt DC, Luis Fuentes V. Cardiomyopathy prevalence in 780 apparently healthy cats in rehoming centres (the CatScan study). J Vet Cardiol 2015;1:S244–S257.
- Elliot P, Andersson B, Arbustini E, et al. Classification of the cardiomyopathies: A position statement from the European society of cardiology working group on myocardial and pericardial diseases. Eur Heart J 2006;29:270–276.
- Schober KE, Savino SI, Yildiz V. Right ventricular involvement in feline hypertrophic cardiomyopathy. J Vet Cardiol 2016;18:297–309.
- Atkins CE, Gallo AM, Kurzman ID, et al. Risk factors, clinical signs and survival in cats with a clinical diagnosis of idiopathic hypertrophic cardiomyopathy: 74 cases (1985–1989). J Am Vet Med Assoc1992;201:613–618.
- Rush JE, Freeman LM, Fenollosa LK, et al. Population and survival characteristics of cats with hypertrophic cardiomyopathy: 260 cases (1990–1999). J Am Vet Med Assoc 2002;220:202–207.
- Payne JR, Luis Fuentes V, Boswood A, et al. Population characteristic and survival in 127 referred cats with hypertrophic cardiomyopathy (1997 to 2005). J Small Anim Pract 2010;51:540–547.
- Payne JR, Borgeat K, Brodbelt DC, et al. Prognostic indicators in cats with hypertrophic cardiomyopathy. J Vet Intern Med 2013;27:1427–1436.
- Payne JR, Borgeat K, Brodbelt DC, et al. Risk factors associated with sudden death vs. congestive heart failure or arterial thromboembolism in cats with hypertrophic cardiomyopathy. J Vet Cardiol2015;S1:S318–S328.
- Hu K, Liu D, Herrmann S, et al. Clinical implication of mitral annular plane systolic excursion for patients with cardiovascular disease. Eur Heart J Cardiovasc Imaging 2013;14:205–212.
- Lang RM, Badano LP, Mor‐Avi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: An update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging 2015;16:233–270.
- Mondillo S, Galderisi M, Ballo P, et al. Left ventricular systolic longitudinal function: Comparison among simple M‐mode, pulsed, and M‐mode color tissue Doppler of mitral annulus in healthy individuals. J Am Soc Echocardiogr 2006;19:1085–1091.
- Haddad F, Hunt SA, Rosenthal DN, et al. Right ventricular function in cardiovascular disease, part I: Anatomy, physiology, aging, and functional assessment of the right ventricle. Circulation 2008;117:1436–1448.
- Kjaergaard J, Iversen KK, Akkan D, et al. Predictors of right ventricular function as measured by tricuspid annular plane systolic excursion in heart failure. Cardiovasc Ultrasound 2009;7:51–58.
- Finocchiaro G, Knowles JW, Pavlovic A, et al. Prevalence and clinical correlates of right ventricular dysfunction in patients with hypertrophic cardiomyopathy. Am J Cardiol 2014;113:361–367.
- Thomas WP, Gaber CE, Jacobs GJ, et al. Recommendations for standards in transthoracic two‐dimensional echocardiography in the dog and cat. Echocardiography Committee of the Specialty of Cardiology, American College of Veterinary Internal Medicine. J Vet Int Med 1993;7:247–252.
- Schober KA, Chetboul VL. Echocardiographic evaluation of left ventricular diastolic function in cats: Hemodynamic determinants and pattern recognition. J Vet Cardiol 2015;S1:S102–S133.
- Koffas H, Dukes‐McEwan J, Corcoran BM, et al. Pulsed tissue Doppler imaging in normal cats and cats with hypertrophic cardiomyopathy. J Vet Intern Med 2006;20:65–77.
- Pariaut R, Saelinger C, Strickland KN, et al. Tricuspid annular plane systolic excursion (TAPSE) in dogs: Reference values and impact of pulmonary hypertension. J Vet Intern Med 2012;26:1148–1154.
- Kaye BM, Borgeat K, Mõtsküla PF, et al. Association of tricuspid annular plane systolic excursion with survival time in Boxer dogs with ventricular arrhythmias. J Vet Intern Med 2015;29:582–588.
- Friedrichs KR, Harr KE, Freeman KP, et al. ASVCP reference interval guidelines: Determination of de novo reference intervals in veterinary species and other related topics. Vet Clin Pathol 2012;41:441–453.
- Carlsson M, Ugander M, Mosén H, et al. Atrioventricular plane displacement is the major contributor to left ventricular pumping in healthy adults, athletes, and patients with dilated cardiomyopathy. Am J Physiol Heart Circ Physiol 2007;292:H1452–H1459.
- Smiseth OA, Torp H, Opdahl A, et al. Myocardial strain imaging: How useful is it in clinical decision making? Eur Heart J 2016;37:1196–1207.
- Urbano‐Moral JA, Rowin EJ, Maron MS, et al. Investigation of global and regional myocardial mechanics with 3‐dimensional speckle tracking echocardiography and relations to hypertrophy and fibrosis in hypertrophic cardiomyopathy. Circ Cardiovasc Imaging 2014;7:11–19.
- Doesch C, Sperb A, Sudarski S, et al. Mitral annular plane systolic excursion is an easy tool for fibrosis detection by late gadolinium enhancement cardiovascular magnetic resonance imaging in patients with hypertrophic cardiomyopathy. Arch Cardiovasc Dis 2015;108:356–366.
- Maron MS, Hauser TH, Dubrow E, et al. Right ventricular involvement in hypertrophic cardiomyopathy. Am J Cardiol 2007;100:1293–1298.
- Schwarz K, Singh S, Dawson D, et al. Right ventricular function in left ventricular disease: Pathophysiology and implications. Heart Lung Circ 2013;22:507–511.
- López‐Candales A, Rajagopalan N, Saxena N, et al. Right ventricular systolic function is not the sole determinant of tricuspid annular motion. Am J Cardiol 2006;98:973–977.
- Häggström J, Andersson ȦO, Falk T, et al. Effect of body weight on echocardiographic measurements in 19,866 pure‐bred cats with or without heart disease. J Vet Intern Med 2016;30:1601–1611.
^Наверх









