Нарушения сердечно-сосудистой-почечной оси у домашних собак и кошек: ветеринарный консенсус

Pouchelon J.L., Atkins C.E., Bussadori C., Oyama M.A., Vaden S.L., Bonagura J.D., Chetboul V., Cowgill L.D., Elliot J., Francey T., Grauer G.F., Fuentes V.L., Moise N.S., Polzin D.J., Van Dongen A.M., Van Israël N. Cardiovascular-renal axis disorders in the domestic dog and cat: a veterinary consensus statement // J Small Anim Pract. 2015 Sep;56(9):537-552.
Абстракт
ЦЕЛИ: Растет понимание сложности взаимодействия между почечной и сердечно-сосудистой системами как в отношении здоровья, так и в отношении болезней. Медицинская профессия приняла термин «кардиоренальный синдром» (CRS), чтобы описать патофизиологическую связь между почками и сердцем при развитии болезни. CRS еще предстоит официально определить и описать ветеринарной профессией, а ее существование и важность для собак и кошек заслуживают расследования. Консенсусная группа CRS, состоящая из девяти ветеринарных кардиологов и семи нефрологов из Европы и Северной Америки, стремилась достичь консенсуса в отношении определения, патофизиологии, диагностики и управления собаками и кошками с «сердечно-сосудистыми заболеваниями почек» (CvRD). С этой целью была использована формальная методология Delphi для определения / формирования консенсуса и определения руководящих принципов.
МЕТОДЫ: После обзора литературы 13 утверждений кандидатов относительно CvRD у собак и кошек были протестированы на консенсус с использованием модифицированного метода Delphi. В качестве новой области интересов хорошо разработаны исследования, специфичные для CRS / CvRD, особенно у собак и кошек. Следовательно, хотя научное обоснование всех рекомендаций было запрошено и использовалось, когда это было возможно, рекомендации в значительной степени зависели от теории, мнения экспертов, небольших клинических исследований и экстраполяции данных, полученных от других видов.
РЕЗУЛЬТАТЫ: Из 13 заявлений 11 достигли консенсуса, а 2 - нет. Модифицированный подход Delphi хорошо работал для достижения консенсуса объективным образом и разработки первоначальных руководящих принципов для CvRD.
Обсуждение: В полученной рукописи описываются консенсусные утверждения для стратегий определения, классификации, диагностики и управления для ветеринарных пациентов с CvRD с акцентом на патологическое взаимодействие между двумя системами органов. Формулируя консенсусные заявления относительно CvRD в ветеринарии, авторы надеются стимулировать интерес и продвижение понимания и управления CvRD у собак и кошек. Использование формализованного метода для достижения консенсуса и разработки руководящих принципов следует рассматривать по другим темам в области ветеринарии.
ВВЕДЕНИЕ
Комплексное взаимодействие между почечной и сердечно-сосудистой системами существует как для обеспечения здоровья, так и для развития патологии. У людей патологические взаимодействия между этими двумя системами органов все в большей степени заслуживают дальнейшего определения, классификации и понимания. Термин «кардиоренальный синдром (CRS)», определяемый как «нарушения сердца и почек, при которых острая или хроническая дисфункция в одном органе может вызывать острую или хроническую дисфункцию другого» (Ronco et al., 2010) была принята врачами для описания это патологическое взаимодействие. CRS подразделяется на следующие пять типов: тип 1, включающий острое обострение сердечной функции, приводящую к повреждению почек, например, у пациентов с острой застойной сердечной недостаточностью (CHF); тип 2, включающий хроническое заболевание сердца, ведущее к повреждению почек, например, у пациентов с хронической сердечной недостаточностью; тип 3, включающий острое ухудшение функции почек, приводящее к повреждению сердца, например, у пациентов с острой почечной недостаточностью (ОПН); тип 4, включающий хроническое заболевание почек (ХЗП), ведущее к сердечному повреждению; и, наконец, тип 5, включающий системное заболевание (ы), приводящее к одновременному повреждению сердца и почек, например, у пациентов с сепсисом, системной гипертонией или амилоидозом (Ronco et al., 2010). Хотя были предложены эпидемиология, диагностика, профилактика и лечение CRS у людей (Ronco et al., 2010, McCullough et al., 2013, Braam et al., 2014, Ronco & Di Lullo 2014), клиническая значимость, время начала патологии и патофизиологические механизмы CRS не полностью понятны (Braam et al., 2014). Единственными признанными фактами являются: (i) объем крови, вазомоторный тон и гемодинамическая стабильность зависят от сердечно-сосудистой и почечной систем и (ii) взаимодействия между этими двумя системами (Bock & Gottlieb 2010). Концепция CRS сочетает сердечно-сосудистую систему и почки как часть одной гомеостатической кардиоренальной оси, что бросает вызов кардиологам и нефрологам, которые соответственно исследуют сердечную и почечную недостаточность, чтобы рассмотреть это в полной перспективе.
Хотя болезни почек и сердечно-сосудистых заболеваний обычно признаются у домашних собак (Detweiler & Patterson 1965, Buchanan 1992, Beardow & Buchanan 1993, Polzin 2011, 2013) и кошек (Buchanan 1992, Riesen et al., 2007 Chakrabarti et al., 2013) в качестве важного источника заболеваемости и смертности (Fleming et al., 2011), взаимодействие между двумя системами еще должно быть формально определено и описано ветеринарной профессией. Консалтинговая группа CRS, состоящая из 16 научных и клинических экспертов, включая 9 ветеринарных кардиологов и 7 ветеринарных нефрологов из Европы и Северной Америки, была создана с целью разработки консенсуса, определений и рекомендаций для кардиоренального синдрома у собак и кошек. Участники дискуссии были выбраны на основе опыта в области кардиологии, гипертонии и нефрологии и признания в качестве экспертов-специалистов в этих соответствующих областях. Группа была намеренно выбрана представителем академических ветеринаров из Западной Европы и Северной Америки, исходя из их способности и заинтересованности в участии в этом проекте и дипломатическом статусе по одной или нескольким клиническим специальностям (Американские и Европейские колледжи ветеринарной медицины [ ACVIM, ECVIM, соответственно, или Европейский колледж ветеринарной клинической патологии и токсикологии). Другие критерии, связанные с этим процессом отбора, включают прошлое участие в разработке соответствующих консенсусных заявлений (Международное общество по почечным интересам [IRIS], Заявление об утверждении гипертензии ACVIM и Заявление ACVIM о диагностике и лечении болезни митрального клапана у собак). Превосходная степень и / или исследовательский опыт в нефрологии / кардиологии также считались желательными атрибутами. Все авторы сертифицированы и в настоящее время участвуют в исследованиях по специальности, а 10 из 16 имеют повышенные ученые степени (3 MS, 6 PhD, 1 MD).
Целями группы были: 1) определить CRS, поскольку он относится к собакам и кошкам как к ветеринарным пациентам; 2) рекомендовать диагностическое тестирование и оценку CRS; 3) предоставить общие рекомендации по лечению пациентов с CRS с акцентом на потенциальное взаимодействие между двумя системами органов и 4) повысить осведомленность о CRS как важном субъекте болезни в ветеринарии, заслуживающем дальнейших исследований. На раннем этапе Группа консенсуса CRS решила обратиться к CRS у ветеринарных пациентов как к «сердечно-сосудистым заболеваниям почек (CvRD)», так как была включена сосудистая сеть, а также сердце, и потому, что, основываясь на опыте сердечно-сосудистых и почечных заболеваний, ожидается, что клинические проявления CvRD у собаки и кошки будут широко варьироваться среди индивидуумов и между видами, исключая их описание как единого клинического синдрома.
Важно подчеркнуть, что проявления сердечных и почечных заболеваний различаются между видами, тем самым ограничивая справедливость получения от данных человека для ветеринарного применения, а также сравнения между собаками и кошками. Сердечная болезнь у людей связана прежде всего с артериальной гипертензией и ишемической болезнью сердца, которая отличается от собак (первичная болезнь клапанов, дилатационная кардиомиопатия и болезнь сердечного червя) и кошек (гипертрофическая кардиомиопатия, другие миопатии и, в меньшей степени, системная гипертензия). Аналогично, заболевания почек человека (гломерулярное заболевание, диабетическая нефропатия, гипертоническая нефропатия, нефросклероз, интерстициальный нефрит и поликистозная болезнь почек (Maschio et al., 1996, Hou et al., 2006)) не коррелируют точно с теми, которые наблюдаются у ветеринарных пациентов (собаки: гломерулярное заболевание, пиелонефрит, острый тубулярный некроз, тубулоинтерстициальное заболевание (Macdougall et al., 1986) и кошки: идиопатическая хроническая конечная стадия заболевания почек, чаще всего характеризующаяся тубулоинтерстициальным фиброзом, обычно неизвестного происхождения (Chakrabarti et al., 2013)). Тем не менее, есть некоторые аспекты болезней и их патофизиологии, которые требуют межвидового сравнения и применения человеческих данных для ветеринарной медицины.
МЕТОДИКА
Консенсусная группа кардио-ренального синдрома включала комитет по управлению и публикации из 5 человек, в состав которого вошли председатель (JLP) и 4 дополнительных руководящих члена (CEA, CB, MAO, SLV), а также рейтинговая группа из 11 членов. Председатель и руководящая группа контролировали поиск в PubMed соответствующей биомедицинской литературы, опубликованной в период с 1995 по 2013 год. Затем комитет подготовил обзор CvRD, который включал 13 сводных заявлений. 13 заявлений охватывали четыре разных подтемы, включая определение, классификацию и патофизиологию (заявления подгруппы 1-2); эпидемиологию, клинические аспекты и диагноз (Подгруппы 2-3 заявления); биомаркеры и визуальную диагностику (заявления подгруппы 3-5); и контроля (Подгруппы 4-3 заявления) CvRD. Обзор литературы и заявления обсуждались на двухдневном собрании всей группы консенсуса CRS в апреле 2013 года. В ходе этого заседания вся Консенсусная группа CRS пересмотрела документы и сводные заявления, чтобы объединиться вокруг пунктов соглашения.
Конечной целью Консалтинговой группы CRS было подготовить консенсусный документ, описывающий CvRD у собаки и кошки. Модифицированный метод Delphi, основанный на руководящих указаниях Haute Autorité de santé (HAS или French National Authority for Health) (Haute Autorité de Santé 2010), был использован для оценки того, достигли ли каждый из 13 проектов сводных заявлений формального консенсуса. Согласно методу, каждый член группы оценивал каждое заявление от 1 до 9, в зависимости от силы их согласия с заявлением, при этом 1 заключалось в том, что заявление совершенно неуместно 9, поскольку заявление является полностью подходящим, а 5 - нерешительным. Среди 16 рейтинговых баллов самые низкие и самые высокие баллы для каждого заявления были отброшены. Это привело к 14 оценкам, таким образом, чтобы оценка не могла составлять <5, а медианное значение должно было быть ≥7, чтобы описание описывалось как достижение консенсуса. Были проведены два раунда консенсусного рейтинга. В начале двухдневного собрания члены группы были ознакомлены с методом оценки и они обсудили и внесли изменения в заявления. После этого обсуждения был проведен первый раунд рейтинга, и были оценены оценки для каждого заявления. Затем группа разделилась в четыре разные подгруппы, каждая из которых возглавлялась членом руководящего комитета (подгруппа 1: CEA, VLF, JE; подгруппа 2: CB, VC, DJP, AMV; подгруппа 3: SLV, JDB, NVI , GFG, подгруппа 4: MAO, TF, LDC, NSM) с задачей пересмотра заявлений на основе результатов и отзывов от первого раунда рейтинга. Впоследствии вся группа вновь была созвана для дальнейшего обсуждения и пересмотра, и к концу совещания была составлена окончательная формулировка каждого из 13 заявлений. В течение следующих нескольких недель участники смогли продолжить рассмотрение заявлений, используя веб-платформу, доступную для всех 16 членов. Через восемь недель после завершения встречи был проведен второй и последний раунд рейтинга с использованием онлайн-платформы с идентичными инструкциями по оценке, процедурами подсчета очков и критериями консенсуса. Для тех утверждений, которые достигли консенсуса, сила консенсуса была определена наименьшим значением из 14 индивидуальных рейтинговых оценок, в которых сильный консенсус определялся как имеющий наименьший индивидуальный показатель ≥7, а хороший консенсус определялся как наименьшая индивидуальная оценка либо 5, либо 6. Окончательные результаты оценки, заявления и вспомогательная информация были собраны в проект рукописи руководящим комитетом, который затем был рассмотрен и отредактирован всеми членами группы до подачи заявки на публикацию.
РЕЗУЛЬТАТЫ
Определение, классификация и патофизиология CvRD
Заявление 1: Сердечно-сосудистые заболевания почек (CvRD) определяются как структурные и / или функциональные повреждения, вызванные заболеванием, токсином или лекарственным средством, для почек и / или сердечно-сосудистой системы, приводящие к нарушению нормальных взаимодействий между этими системами, и приводящие к поражению одного или обоих. (Хороший консенсус, медиана, 8, диапазон 5-9)
Заявление 2: CvRD включает подгруппы CvRDH, CvRDK и CvRDO, чтобы отражать почечную болезнь / дисфункцию, исходящую от болезни, связанной с сердечно-сосудистой системой; сердечно-сосудистые заболевания / дисфункция, вторичные по отношению к заболеванию почек и одновременное ухудшение обеих систем, вызванное одновременным первичным сердечно-сосудистым и почечным заболеванием или «другими» процессами заболевания, наркотиками, токсинами или токсикантами, которые влияют на обе системы, соответственно. Эти три категории могут быть далее подразделены на стабильное заболевание (S) или нестабильное заболевание (U), основанное на клиническом представлении пациента. (Хороший консенсус, медиана, 7, диапазон, 6-9)
Каждое из этих двух утверждений достигло хорошего консенсуса. Ключевой проблемой как CRS, так и CvRD является то, как взаимодействуют почки и сердечно-сосудистые системы, в том числе потенциальный вред по трем различным осям, от почек до сердечно-сосудистой системы, от сердечно-сосудистой системы до почек и от внешних процессов заболевания до обоих. В случаях, когда болезнь сосуществует в обеих органных системах, может быть трудно определить направленность CvRD или если сосуществует одновременное первичное заболевание. Концепция CvRD подчеркивает взаимосвязанные функции двух систем органов и поощряет полное и раннее исследование функции сердца в случаях заболевания почек и функции почек в случаях сердечных заболеваний. В человеческой медицине CRS является относительно новой, но развивающейся областью медицинского исследования, в то время как понимание взаимосвязи между животными (CvRD) находится в зачаточном состоянии. Поэтому ожидается, что предлагаемая схема определения и классификации для CvRD у собак и кошек потребует переоценки и модификации, поскольку проводится более ветеринарное исследование с участием CvRD.
Эпидемиология, клинические аспекты и диагностика CvRD
Заявление 3: Несмотря на отсутствие конкретных данных о патофизиологии CvRD в ветеринарии, в доступной литературе предлагается вероятность того, что патофизиология CvRD у животных имеет общие закономерности с человеческим CRS, а именно сложное взаимодействие гемодинамических изменений, нейрогормональной активации и реактивных форм кислорода, чтобы назвать несколько патогенетических факторов. (Хороший консенсус, средний рейтинг, 8, диапазон, 5-9)
Это заявление достигло хорошего консенсуса. Понимание CRS у людей является неполным (Ronco & Di Lullo 2014), а в ветеринарной медицине существование и точный характер CvRD в значительной степени являются умозрительными. Тем не менее, у собак и кошек существуют известные этиологические заболевания, которые характеризуются пагубными взаимодействиями между почками и сердечно-сосудистыми системами (таблица 1) . Концепция CRS, которая включает двунаправленный путь повреждения, когда болезнь любого из органов прямо или косвенно способствует повреждению другого (рис. 1), представляет более широкий взгляд на жидкостный и гемодинамический гомеостаз по сравнению с более традиционной точкой зрения, в которой рассматривается почка и сердечно-сосудистые нарушения как отдельные патофизиологические сущности. В следующем разделе будут обсуждаться эпидемиология и патофизиология каждого из трех классов CvRD.
Таблица 1 - Этиология сердечно-сосудистых заболеваний почек (CvRD) у собак и кошек
| CvRD класс | Этиология |
| CvRDH | Системная гипертензия, ведущая к болезни клубочков |
| Кардиогенный шок, низкий сердечный выброс и системная гипотония, приводящие к уменьшению почечной перфузии, азотемии и острому повреждению почек | |
| Системная артериальная тромбоэмболия, ведущая к почечному инфаркту | |
| Дирофиляриоз или кавальный синдром, приводящий к гломерулонефриту или ОПН, соответственно | |
| Пассивное повреждение почек при сердечной недостаточности * | |
| CvRDK | Почечная опосредованная системная гипертензия, приводящая к увеличению послеоперационной нагрузки, гипертрофии левого желудочка, ухудшению митральной или аортальной недостаточности, аритмий, васкулопатии или ретинопатии |
| Объемная перегрузка, приводящая к перегрузке или системной гипертонии | |
| Гипокалиемия или гиперкалиемия, приводящие к сердечным аритмиям | |
| Снижение почечного клиренса лекарств (например, дигоксина), что приводит к токсичности | |
| Уремическая гиподипсия, анорексия или рвота, приводящие к истощению объема и снижению сердечного выброса и перфузии | |
| Уремический перикардит | |
| Активация оси ренин-ангиотензин-альдостерона, приводящая к удержанию натрия и воды, ремоделированию сердца и сосудов или перегрузке | |
| Анемия, вторичная по отношению к хроническому заболеванию почек, приводящая к объемной перегрузке и уменьшению оксигенации сердечной ткани * | |
| CvRDO | Септическая или неопластическая эмболия, приводящая к почечному и сердечному инфаркту |
| Расширение и заворот желудка, приводящие к сердечным аритмиям и азотемии | |
| Инфекционные заболевания (например, Trypanosoma cruzi) | |
| Накопление гликогенное, ведущее к отложению гликогена в почках и сердце | |
| Амилоидоз, ведущий к отложению амилоида в почках и сердечных тканях * |
* Причины, которые предлагаются, возможны или подозреваются. См. Текст для описания различных классов CvRD.
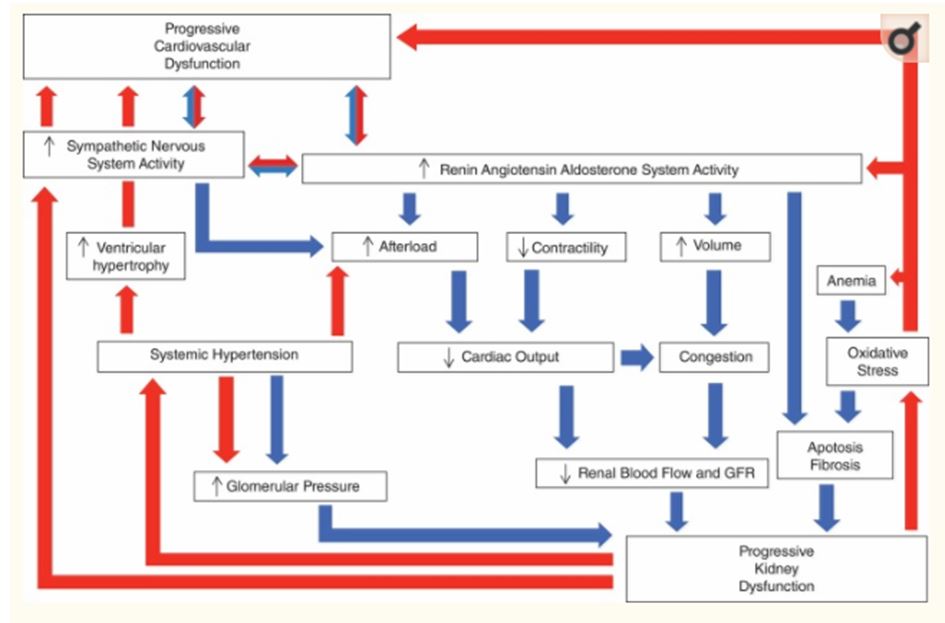
Рис. 1 - Постулированные механизмы, лежащие в основе взаимосвязи между сердечной недостаточностью (HF) и почечной дисфункцией
Синие стрелки указывают пути, по которым HF может привести к почечной недостаточности. Красные стрелки указывают пути, по которым почечная недостаточность может привести к HF. Относительная важность этих механизмов (и дополнительных механизмов, не обсуждаемых) неизвестна (т. е. блоки не нарисованы в масштабе). Эта цифра была изменена, чтобы включить системную гипертензию, важный сосудистый компонент в CvRD. От Бока. JS. Готлиб, СС. 2010, адаптировано с разрешения. СКФ, скорость клубочковой фильтрации, РААС, ренин-ангиотензин-альдостероновая система, СНС, симпатическая нервная система.
Эпидемиология и патофизиология CvRDH
CvRDH относится к повреждению почек или дисфункции, исходящей от первичного процесса заболевания, включающего сердечно-сосудистую систему. Потенциальные механизмы CvRDH включают снижение перфузии почек, вторичную по отношению к снижению сердечного выброса; активации нейроэндокринных систем, а именно системы ренин-ангиотензин-альдостерона (РААС) и симпатической нервной системы (СНС); генерирование активных форм кислорода аномальной или поврежденной эндотелиальной тканью и пассивный венозный застой почки (таблица 1) (Haase et al., 2013, McCullough et al., 2013). Резкое снижение сердечного выброса может привести к снижению скорости клубочковой фильтрации (СКФ), увеличению креатинина сыворотки и азота мочевины крови (БУН) и снижению выхода мочи (Liang et al., 2008). Как у людей, так и у животных увеличение креатинина всего на 0,3 мг / дл (26,5 мкмоль / л) считается показателем ОПН (Jose et al., 2006, Harison et al., 2012, Международное общество по интересам почек 2014 г. ). IRIS предложила диагностические критерии для ОПН у собак и кошек (Таблица 2) (Международное общество по интересам почечных заболеваний 2014 года). Эта система классификации включает в себя континуум функционального и паренхимного повреждения от наименее до самых суровых проявлений. Клиническое представление ОПН включает предварительные и постренальные состояния, которые могут быть независимыми или сочетаться с внутренним почечным повреждением в зависимости от функционального происхождения, степени и продолжительности условий, вызывающих заболевание. Мягкая ОПН, определяемый как концентрация креатинина в сыворотке> 1 • 6 мг / дл (1 • 7-2 • 5;> 141 мкмоль / л, 142-220), обнаруживается у собак или кошек, получавших лечение при сердечной недостаточности (Goutal et al. . 2010). Было показано, что эти относительно скромные значения, даже если они не могут превышать соответствующий -лабораторный диапазон корреляции, если это состояние устойчиво, ухудшают исход у людей с сердечными заболеваниями (Jose et al., 2006), а также у собак и кошек с различными основными процессами болезни (Harison et al., 2012). Являются ли эти изменения указанием на постоянное структурное повреждение почек, еще предстоит определить у собак и кошек. Авторы рекомендуют, чтобы при лечении животных с обострением ХСН была назначена минимальная доза диуретики, необходимая для устранения признаков перегрузки и тщательно оценивались почечные значения. Тем не менее, нет убедительных доказательств того, что развитие креатинина сыворотки>> 6 г / дл (> 141 мкмоль / л) у кошек и собак с сердечной недостаточностью приводит к плохим клиническим результатам. Это потребует адекватного ожидаемого клинического испытания, которое не было предпринято. Таким образом, креатинин сыворотки > 6 г / дл (> 141 мкмоль / л) не должен использоваться в качестве индикатора для отказа от необходимой терапии у пациента с плохо контролируемой сердечной недостаточностью.
Таблица 2 - Международное рейтинговое агентство по оценке почечных заболеваний (IRIS) оценивает критерии острой почечной недостаточности (ОПН) у собак и кошек (с разрешения Borgarelli et al., 2001)(2001)
| ОПН стадии | Сывороточный креатинин | Клиническая характеристика |
| I | <1 • 6 мг/дЛ (<140 µmol/l) | Неазотемическая ОПН
|
| II | 1 • 7–2 • 5 мг/дЛ (141–220 µmol/L) | Умеренная ОПН:
|
| III | 2 • 6–5 • 0 mg/dL (221–439 µmol/L) | От умеренной до тяжелой ОПН: а. Документированная ОПН и увеличение степени азотемии и функциональной почечной недостаточности |
| IV | 5 • 1–10 • 0 mg/dL (440–880 µmol/L) | б. Выраженная ОПН |
| V | >10 • 0 mg/dL (>880 µmol/L) | с. Терминальная ОПН |
Каждый класс ОПН далее подразделяется на основании олигурии, олигонуклеотидов (NO) или олигоанурии (O), а также любого требования к заместительной почечной терапии (RRT).
† Объемный отзыв - увеличение производства мочи до > 1 мл / кг / ч в течение 6 часов; и / или снижение содержания креатинина в сыворотке до исходного уровня в течение 48 часов) Известно, что у людей дополнительные механизмы за пределами снижения сердечного выброса и гломерулярного давления приводят к повреждению почек. Градиент гидростатической гломерулярной фильтрации, определяемый как разница между гломерулярным артериальным давлением и капсульным гидростатическим давлением, в значительной степени зависит от системного венозного давления. Застой ткани почек, из-за плохой сердечной функции и повышенного системного венозного давления, преимущественно увеличивает давление в капсуле, уменьшает давление и скорость фильтрации клубочков и существенно снижает функцию почек (Dupont et al., 2011). У людей с сердечной недостаточностью неполное разрешение венозной перегрузки является основной причиной ухудшения функции почек (Testani et al., 2011, Guazzi et al., 2013) и связано с более плохими результатами терапии (Mullens et al., 2009). Читатель может распознать дилемму в попытке сбалансировать отрицательный эффект мочегонных действий на артериальную почечную перфузию против положительного влияния на застой венозных почек.
RAAS и, в частности, ангиотензин II, осаждают и опосредуют опосредованную окислительным и цитокиновым повреждением, воспаление и гибелью клеток (Mitani et al., 2013). Результирующая эндотелиальная дисфункция и образование активных форм кислорода (ROS) обеспечивают важную связь между почечной и сердечной дисфункцией (рис. 1) (Braam et al., 2014). CHF и сопутствующие повышение уровней цитокинов, снижение потребления железа и абсорбция и подавление ангиотензинпревращающего фермента (ACE) (ангиотензин II является секреторным средством эритропоэтина) способствуют анемии у людей (Pallazzuoli et al., 2008, Chalhoub et al., 2011). Считается также, что хроническое воспаление снижает чувствительность к эритропоэтину и, наряду с повреждением почек и уменьшением производства эритропоэтина, способствует анемии (Chalhoub et al., 2011). Уменьшенный или неэффективный циркулирующий эритропоэтин уменьшает гемоглобин и его антиоксидантные свойства и способствует CvRDH, благодаря повышенному окислительному стрессу и апоптозу почек и сердечных клеток (Silverberg et al., 2006). Важность гемоглобина в CvRDH является предметом дебатов, поскольку терапия эритропоэтином, используемая для увеличения концентрации гемоглобина у пациентов с сердечной недостаточностью, не была связана с улучшением результатов терапии пациента (Jackevicius et al., 2014).
Распространенность CvRDH у собак и кошек неизвестна; однако частота первичного заболевания почек увеличивается с возрастом (Ross & Osborne 2006, Polzin 2011). Таким образом, пожилые животные с сердечно-сосудистыми заболеваниями подвергаются дополнительному риску развития первичного заболевания почек и CvRDO. Достижения в медицинской терапии CHF привели к увеличению продолжительности жизни (Ettinger et al., 1998, Haggstrom et al., 2008, BENCH Study Group, Bernay и др., 2010), тем самым увеличивая потенциал развития первичного заболевания почек с течением времени, а также кумулятивное воздействие потенциально нефротоксичных препаратов, таких как диуретики и ингибиторы АПФ (ACEI). Известно, что ACEI, вездесущие при лечении сердечной недостаточности и гипертонии, нефротоксичны при очень высоких (70 ×) дозах и при введении обессиленным по объему собакам (MacDonald et al., 1987). Хотя известно, что они не являются непосредственно нефротоксичными, сильные петлевые диуретики, такие как фуросемид, при высоких дозах, связаны с сокращением объема и ухудшением функции почек, что указывает на их возможную роль в потенцировании индуцированной ACEI нефротоксичности (Steimle et al., 1997, Schrier et 2004). Кроме того, петлевые диуретики стимулируют систему RAAS (Lantis et al., 2014) с хорошо документированным патологическим воздействием на почки (Francis et al., 1990). Новые данные свидетельствуют о том, что фуросемид, увеличивая натрий, достигающий дистальной канальцы, увеличивает секрецию аденозина, которая через вазоактивные механизмы ухудшает почечную функцию и способствует устойчивости к диуретику (Vallon et al., 2008, Lazzarini et al., 2012). Чтобы уменьшить ухудшение функции почек у людей с сердечной недостаточностью, изучаются альтернативные диуретики (Costanzo et al., 2007, Givertz et al., 2007). Однако существуют противоречивые исследования. Большое ретроспективное исследование пациентов с сердечной недостаточностью у человека показало, что ожидаемый значительный рост креатинина в сыворотке с введением фуросемида, хотя и статистически значимый, был очень малым (0,11 мг / дл, 9 • 7 мкмоль / л [0,4%]) в течение 5 дней после госпитализации) и мало объясняли различия в концентрации креатинина в сыворотке и оценивали GFR (El-Refai et al., 2011). Важно отметить, что эти результаты согласуются с меньшим проспективным исследованием влияния внутривенного фуросемида при различных дозах и методах введения (Felker et al., 2011). Своевременный обзор этого материала детализирует противоречивые доказательства практически во всех аспектах развития, профилактики и лечения CRS у людей (Lazzarini et al., 2012). Тем не менее, авторы смогли сделать вывод из имеющихся данных о том, что «... острая профилактика КРС и лечение могут рассматриваться в числе основных целей контроля обострения ХСН» и что «... петлевые диуретики следует вводить с минимальной дозой, достаточной для оптимизации объема статуса и облегчить симптомы и симптомы перегруженности, не вызывая чрезмерного сокращения внутрисосудистого объема, что может привести к гипотензии и / или почечной дисфункции ». Недавно была рассмотрена дилемма непоследовательных результатов относительно пользы от вреда петлевых диуретиков (Hanna & Deschamps 2014). Основываясь на анализе данных, эти ученые-клиницисты считают, что подмножество пациентов с ХСН ухудшается агрессивным диурезом. Эти авторы заключают, что «... застой находятся в центре острых (сердечной недостаточности) синдромов. Агрессивное дезактивация значительно улучшает условия почечного и миокардиального патогенеза и желудочковой нагрузки. Это позволяет улучшить функцию почек, чтобы поддерживать диурез с более низкими мочегонными дозами. Это также позволяет пациенту переносить более низкое системное давление без компромиссов с перфузией миокарда или почек. Сочетание двух конкретных факторов предсказывает плохую толерантность к острому диурезу: (1) нерасширенные левые и правые желудочки с резким соотношением давления и объема (например, острое сердечное заболевание, диастолическая [сердечная недостаточность]) и ( 2) нет или минимальный периферический отек. Пациенты с тяжелым отеком обычно переносят агрессивный диурез, особенно если у них хорошее время наполнения плазмы. Напротив, у пациентов без острого периферического отека и с плохо совместимыми небольшими желудочками объем преднагрузки резко не увеличивается, но давление предварительной нагрузки (конечное диастолическое давление левого желудочка) увеличивается. Таким образом, у этих пациентов наблюдается отек легких, несмотря на то, что он зависит от объема предварительной нагрузки. Диурез может плохо переноситься при отсутствии периферического отека, что приводит к большому изменению сердечного выброса и, как следствие, почечной недостаточности и гипотонии ». Далее они делают вывод о том, что лучшая терапия - это тщательное диуретическое введение в сочетании с вазодилататорной терапии.
У собак и кошек существование CvRDH косвенно подтверждается наблюдением, что дисфункция почек увеличивается с выраженностью сердечных заболеваний. В ретроспективном исследовании (Nicolle et al., 2007) 50% из 124 собак с хронической клапанной сердечной недостаточностью были азотемичными, и это обнаружение присутствовало у 70% собак с наиболее тяжелыми стадиями заболевания. У собак с тяжелым заболеванием как сывороточный уровень мочевины, так и креатинин были выше, а СКФ была ниже (почти на половину) против собак с более умеренной сердечной болезнью. Как ясно указано авторами, эти различия в азотемическом статусе и СКФ между стадиями легкой и тяжелой сердечной недостаточности могут быть связаны как с воздействием препаратов, используемых для медицинского лечения сердечных заболеваний (например, иAПФ и диуретиков), так и на эффект клапанного заболевания на почечную функцию, тем самым иллюстрируя необходимость дальнейших исследований для установления прямых и косвенных причинно-следственных связей между прогрессированием сердечных заболеваний и развитием почечной дисфункции. Аналогичным образом, в ретроспективном исследовании кошек с гипертрофической кардиомиопатией (Gouni et al., 2008) азотемия присутствовала в 59% случаев. Опять же, как заявили авторы, необходимы дальнейшие проспективные исследования для документирования патофизиологических событий, лежащих в основе возникновения азотемии при гипертрофической кардиомиопатии кошек, и определения степени, в которой сердечно-сосудистые заболевания (и лекарственные средства, используемые при их лечении) прямо или косвенно индуцируют повреждение почек. Заболевания сосудистой сети включены в предлагаемое определение CvRD и включают такие нарушения, как системная гипертензия (SHT) (рис. 1). Хорошо описанный гипертоническое клубочковое поражение у ветеринарных пациентов (Wehner et al., 2008, Surman et al., 2012, IRIS Canine GN Study Group, подгруппа и др., 2013) и среди различных предложенных этиологий CvRD (рис. 1), SHT является одним из самых правдоподобных.
Эпидемиология и патофизиология CvRDK
CvRDK относится к сердечно-сосудистым повреждениям или дисфункции, исходящим от первичного заболевания, связанного с почками. Существует мало прямых доказательств для CvRDK у собак и кошек (Carlos Sampedrano et al., 2006, Wilson et al., 2010). Аналогично, у людей есть больше знаний и клинического опыта относительно CvRDH, чем для CvRDK (Ronco et al., 2008). Известны и подозреваются отрицательные эффекты заболевания почек на сердечно-сосудистую систему (Bagshaw et al., 2013, Tumlin et al., 2013, Ronco & Di Lullo 2014). Например, аномалии электролитов, такие как гиперкалиемия, могут усложнять как ОПН, так и ХБП и связаны с сердечными аритмиями (Bagshaw et al., 2013). Различные лекарственные средства, используемые для лечения сердечных заболеваний, такие как дигоксин, эналаприл и атенолол, подвергаются почечной экскреции и могут быть причиной - первичной дисфункции почек, с уменьшением лекарственного средства и могут приводить к признакам токсичности, которые включают аритмии, гипотонию и ухудшение функции миокарда. Объем жидкости и гемодинамический статус практически всегда ненормальны у пациентов с тяжелой болезнью почек (Much & Wilcox 1982, Polzin 2011). Уремические пациенты, которые являются анорексичными, а также гипоцезичными и с частой рвотой, скорее всего, еще больше истощаются по объему, что приводит к снижению сердечного выброса. Повреждение почек может также приводить к системной перегрузке объемом, что способствует перегрузке, особенно у животных с сосуществующими сердечными заболеваниями, такими как болезнь клапанов, дилатационная кардиомиопатия, диастолическая дисфункция (гипертрофическая кардиомиопатия и гипертоническая болезнь сердца) и тяжелая анемия (Wilson et al., 2010) ). Анемия ХБП вряд ли играет здесь значительную роль, так как она обычно является низкосспецифичной, если в дополнение к ХБП не действуют другие факторы (хроническое воспаление, неоплазия и т. Д.). SHT является распространенным последствием ХЗП и может приводить к гипертрофии и дисфункции миокарда и обоих этих патпроцессов кошек (Chetboul et al., 2003, Henik et al., 2004, Carlos Sampedrano et al., 2006) и собак (Misbach et al., 2011). Наконец, сама азотемия может оказывать неблагоприятное воздействие на сердечные миоциты (Mall et al., 1990).
Эпидемиология и патофизиология CvRDO
CvRDO относится к повреждению почек и сердечно-сосудистой системы или дисфункции, исходящей из процесса первичной болезни за пределами двух систем или случаев сосуществования первичных заболеваний почек и сердечно-сосудистых заболеваний (таблица 1). Примеры первых включают сепсис и инфекционные заболевания (Mehta et al., 2013), а пример последнего включает животное с первичным клубочковым заболеванием и дегенерацией миксоматозного митрального клапана. После установления первичных заболеваний почек и сердечно-сосудистых заболеваний CvRDO относится к ранее описанным взаимодействиям между двумя системами, которые могут ускорить повреждение одного или обоих органов. В настоящее время эти взаимодействия плохо определены, и отсутствуют убедительные, опубликованные данные для CvRDO у собак и кошек.
Клиническая постановка и оценка CvRD
Диагноз заболевания почек или сердечно-сосудистых заболеваний требует интеграции информации, полученной из нескольких источников. Представляющая жалоба, история болезни и физическое обследование могут предупредить врача о почках, сердце или сосудистой сети, как о необходимости дальнейшего диагностического тестирования. Анализ крови и мочи, измерение неинвазивного артериального давления и рентгенографическая и ультразвуковая визуализация являются диагностическими инструментами, обычно доступными как для почек, так и для сердечно-сосудистых заболеваний. Точная диагностика и постановка необходимы для выявления CvRD и разработки последующих терапевтических планов.
Стадия сердечной болезни при CvRD
Заявление 4: Рассматривая потенциальное участие сердца в CvRD, наиболее подходящей системой классификации является Международная система сердечно-сосудистых заболеваний (ISACHC). (Нет консенсуса, средний рейтинг, 7, диапазон, 2-9)
Это утверждение не достигло консенсуса из-за трех индивидуальных оценок, которые были <5. Система ISACHC классифицирует животных на основе ограниченных показателей, таких как клинические признаки сердечной недостаточности и наличия или отсутствия сердечной гипертрофии (Международный совет по здоровью сердца сердца 1999 года). Одной из слабых сторон системы ISACHC является ее неспецифичность в отношении анатомического или этиологического диагноза. Тем не менее, альтернативные системы, такие как Американская коллегия ветеринарной системы внутренней медицины, специально разработанная для собак с дегенерацией миксоматозного митрального клапана (Atkins et al., 2009), не учитывают важные сердечно-сосудистые нарушения, которые могут развиваться в CvRD, включая системную гипертензию, диастолическая и систолическая дисфункция, аритмии и изменения в биомаркерах. В контексте CvRD ISACHC или подобные системы являются изолированными неполными средствами для категоризации участия сердечно-сосудистой системы. Дополнительные потенциальные диагностические и промежуточные инструменты, такие как кардиография и биомаркеры, обсуждаются в последующих разделах.
Стадия острой почечной недостаточности и ХЗП в CvRD
Заявление 5: Рассматривая потенциальное участие почек в CvRD, наиболее подходящей классификацией для лечения ОПН и ХЗП являются системы классификации IRIS. (Хороший консенсус, средний рейтинг, 8,5, диапазон, 6-9)
Это заявление достигло хорошего консенсуса. В человеческой и ветеринарной медицине термин ОПН отражает широкий спектр острых повреждений почек. Системы ИРИС для ОПН (таблица 2) и CKD (Международное общество по интересам почек 2014) были сочтены полезными при оценке потенциального участия почек в CvRD. Системы IRIS охватывают континуум повреждения от легкой до тяжелой степени, включая несколько ключевых показателей функции почек. ОПН выявляется в результате резкого повышения концентрации креатинина в сыворотке, внезапного появления глюкозурии или цилиндрурии или внезапного снижения концентрации мочи. Каждый класс ОПН далее подразделяется на основе текущего характера производства мочи. Другие биохимические аномалии, которые часто сопровождают ОПН, включая микроальбуминурию и соотношение в мочи белка с креатинином, учитываются в системе IRIS. Основываясь на рекомендациях IRIS, относительно небольшие изменения концентрации креатинина в сыворотке могут сигнализировать ОПН, а тяжесть ОПН может колебаться, когда пациент улучшает, ухудшает или переходит к ХБП. Система IRIS для CKD основана на маркерах функции почек, включая креатинин сыворотки и протеинурию. Руководящие принципы CKD также включают системное артериальное давление, которое является важным патофизиологическим механизмом CRS (рис. 1) (Ronco & Di Lullo 2014). Таким образом, в отличие от существующих систем сердечно-сосудистой системы, рекомендации IRIS по заболеванию почек были признаны достаточно полными для описания повреждений почек и заболеваний в CvRD.
Биомаркеры и изображения CvRD
Биомаркеры CvRD
Биомаркеры были определены как «характеристика, которая объективно измеряется и оценивается как показатель нормальных биологических процессов, патогенных процессов или фармакологических реакций на терапевтическое вмешательство» (Biomarkers Definitions Working Group, 2001). В идеале любой конкретный биомаркер не только отражает серьезность патологического процесса, но также может использоваться для оценки риска неблагоприятных событий, прогнозирования исхода и руководства терапии. В ветеринарной медицине биомаркеры обычно относятся к веществам, которые могут быть измерены либо в крови, либо в моче. Консенсусная группа обсудила вопрос о том, можно ли использовать существующие биомаркеры для лечения заболеваний почек или сердечно-сосудистых заболеваний, чтобы конкретно диагностировать, прогнозировать результат или вести терапию в CvRD.
Заявление 6: В настоящее время нет биомаркеров, специфичных для CvRDH. Последствия сердечных заболеваний или сердечной терапии на почках следует оценивать с помощью традиционных тестов функции / повреждения почек, а также новых биомаркеров, которые были разработаны. Сердечные биомаркеры, такие как натрийуретический пептид N-конца про-В-типа (NT-proBNP) и сердечный тропонин-I (cTnI), могут быть полезны для установления сердечных заболеваний или сердечного повреждения (Хороший консенсус, средний рейтинг, 7,5, диапазон, 6-9)
Это заявление достигло хорошего консенсуса. Биохимические и биомаркерные анализы для оценки функции почек широко используются и принимаются (Таблица .3). Например, креатинин сыворотки используется для оценки СКФ и сывороточного и мочевого альбумина, а общие концентрации белка используются для оценки гломерулярной пермелективности. Концентрация глюкозы и аминокислот в моче используется для оценки проксимальной трубчатой функции, в то время как концентрации электролитов в сыворотке и концентрации бикарбоната отражают способность почек поддерживать баланс электролитов и кислотно-щелочного баланса. Наконец, удельный вес мочи позволяет оценить концентрационную функцию почек. Валидность этих маркеров хорошо установлена как при первичных остром, так и в хроническом почечном повреждении (Polzin 2011), и хотя их специфичность для дифференциации первичного повреждения почек против CvRDH не тестирована, эти традиционные маркеры, вероятно, адекватно чувствительны к обнаружению дисфункции почек из-за CvRDH. Поиск новых биомаркеров повреждения почек и маркеров, характерных только для CRS или CvRD, является предметом значительного интереса как у людей, так и у ветеринаров (Maddens et al., 2011, Monti et al., 2012, Tvarijonaviciute et al., 2012, Cobrin et al. 2013, Daure et al., 2013, De Loor et al., 2013, Kai et al., 2013, Rossi et al., 2013, Segev et al., 2013). Сокращенный список потенциальных маркеров для различных аспектов функции почек представлен в Таблице 3.
Таблица 3 - Традиционные и новые тесты крови и мочи для оценки различных функций почек
| Почечный показатель | Тест | |
| Показатель скорости клубочковой фильтрации | Традиционные анализы крови и мочи |
|
| Потенциальные новые маркеры | Симметричный диметиларгинин (SDMA) | |
| Гломерулярная пермселективность | Традиционные анализы крови и мочи |
|
| Потенциальные новые маркеры | Мочевой иммуноглобулин G | |
| Клубочковое поражение или дисфункция | Традиционные анализы крови и мочи |
|
| Потенциальные новые маркеры |
|
|
Заявление 7: В настоящее время нет конкретных биомаркеров для CvRDK. Последствия заболевания почек на сердце (CvRDK) следует оценивать с помощью натрийуретического пептида N-терминального про-B-типа (NT-proBNP) сердечного биомаркера и сердечного тропонина-I (cTnI). Биомаркеры функции / повреждения почек доступны, но их необходимо оценивать в условиях сердечной болезни. (Нет консенсуса, средний рейтинг, 7, диапазон 3-8).
Это заявление не достигало группового консенсуса из-за двух индивидуальных баллов, которые составляли <5. Наиболее распространенными испытаниями биомаркеров, используемыми для оценки сердечно-сосудистых заболеваний, являются N-терминальный натрийуретический пептид pro-B-типа (NT-proBNP), натрийуретический пептид B-типа (BNP), N-концевой проатриальный натрийуретический пептид (NT-proANP) и сердечный тропонин I (cTnI). Хотя эти биомаркеры хорошо изучены в условиях первичных сердечно-сосудистых заболеваний, таких как кардиомиопатия и болезни клапанов (DeFrancesco et al., 2007, Boswood et al., 2008, Connolly 2010, Oyama et al., 2013), их достоверность менее обоснована, чем для биомаркеров, используемых для оценки функции почек, таких как креатинин и удельный вес мочи. Диагностические рекомендации, касающиеся сердечных биомаркеров, ослабляются значительными «серыми зонами», которые влияют на способность стратифицировать популяции пациентов только на основе результатов анализа (Oyama et al., 2013). Натриуретические пептиды, включая NT-proBNP, BNP и NT-proANP, конститутивно продуцируются миокардом и помогают регулировать объем плазмы, экскрецию натрия и вазомоторный тонус как в отношении здоровья, так и в болезни (Potter et al., 2009). Таким образом, эта система по своей сути регулируется вверх или вниз с момента, мгновение и изменяется также со стадией болезни, что потенциально приводит к ошибочным выводам. Кроме того, признается клинически значимое индивидуальное и породное изменение как у здоровых, так и у здоровых людей (Kellihan et al., 2009, Sjostrand et al., 2014). Кроме того, в настройках, применимых к CvRDK, было проведено несколько исследований сердечных биомаркеров. У животных с явно нормальной сердечной функцией, но с острым или хроническим повреждением почек, концентрации NT-proBNP, BNP и cTnI в сыворотке или плазме повышаются (Lalor et al., 2009, Schmidt et al., 2009, Sharkey et al., 2009, Miyagawa et al., 2013), поскольку все три, по крайней мере, частично зависят от функции почек для выделения. Поэтому трудно понять, отражает ли повышенные концентрации натрийуретического пептида и cTn1 сердечное повреждение, нормальное изменение или снижение экскреции. Сердечный тропонин является частью комплекса актин-миозин, а у здоровых людей концентрация cTnI в сыворотке или плазме должна быть очень низкой. Исследования показывают, что концентрации cTnI повышаются у собак и кошек с первичной и вторичной сердечной недостаточностью и прогнозируют клинический результат (Oyama & Sisson 2004, Fonfara et al., 2010, Hezzell et al., 2012, Langhorn et al., 2013). Это говорит о том, что cTnI может обнаружить субклиническую сердечную травму из-за CvRDK; однако интерпретация cTnI-анализа омрачена отсутствием информации о времени и величине высвобождения cTnI при многих патологических состояниях.
Методы визуальной диагностики в CvRD
Заявление 8: Торакальная рентгенография рекомендуется для оценки наличия или отсутствия застойной сердечной недостаточности, и рекомендуется провести эхокардиографию для оценки морфологии сердца, поражения и оценить соответствующие параметры гемодинамики. (Сильный консенсус, средний рейтинг, 8, диапазон, 7-9)
Это заявление достигло решительного консенсуса. Диагностическая визуализация играет важную роль в оценке сердечной функции. Радиографические и ультразвуковые методы визуализации обеспечивают морфологические проявления анатомии и функции. Эти данные и дополнительные данные получены из истории, физического обследования, электрокардиографии и лабораторных анализов крови и мочи. Вместе эта комбинация данных позволяет определить наличие, причину, тяжесть и последствия сердечных заболеваний. Как правило, целью кардиоторакального рентгенографического исследования является выявление изменений сердечного силуэта, сосудистых структур и паренхиматозной структуры легких, - в конечном счете, определение наличия признаков сердечной болезни или ХСН. Эхокардиография используется для оценки морфологии и функции сердца. Доплеровская эхокардиография, включая спектральный доплеровский, цветной доплеровский метод, доплеровский тканевой допплер и более совершенные методы, такие как деформация, скорость деформации и 2D-спекл-слежение, дает конкретную информацию о скорости и направлении кровотока и движения миокарда (Chetboul 2010, Chetboul & Tissier 2012) , Продольные изменения в рентгенографических и эхокардиографических показателях помогают определить заболеваемость и прогнозировать смертность у собак и кошек с сердечными заболеваниями (Lord et al., 2011, Reynolds et al., 2012). Таким образом, рентгенографические и эхокардиографические методы визуализации представляют собой два краеугольных камня кардиологического обследования. Читатель отсылается к нескольким отличным обзорам кардиоторакальной радиографической и эхокардиографической интерпретации для получения дополнительной информации (Thomas et al., 1993, Buchanan & Bucheler 1995, Litster & Buchanan 2000, Guglielmini et al., 2009, Chetboul 2010, Schober 2010, Chetboul & Tissier 2012 ).
Заявление 9: Почечная визуализация рекомендуется для улучшения диагностики, прогнозирования и руководства потенциальной терапией в CvRD. Обычные абдоминальные рентгенограммы и ультразвук рекомендуются для выявления морфологических аномалий и определения базовой этиологии. (Хороший консенсус, средний рейтинг, 8, диапазон, 6-9)
Это заявление достигло хорошего консенсуса. Для оценки почек и мочевой системы доступны различные методы визуализации. Простой ортогональный рентгенографический осмотр, в частности, вентродорсальный вид, позволяет определять размер и число почек и может свидетельствовать об односторонних или двусторонних отклонениях или различиях в размере, форме и расположению почек, а также об обнаружении присутствия радиоконтрастных уролитов (Rivers & Johnston 1996, Polzin 2011, Bartges 2012). Ультразвуковое исследование почек и мочевых путей позволяет визуализировать почечные паренхиматозные аномалии, почечную тазовую и мочеточную дилатацию, аномалии почечного кровотока, инфаркты, кисты, минерализацию и уролиты и помогает достичь диагноза пиелонефрита, лимфомы или токсикоза этиленгликолем (Rivers & Johnston 1996, Lamb 1998, Debruyn et al., 2012). Самым большим ограничением для ультразвуковой оценки является отсутствие чувствительности к незначительным изменениям в анатомии почечных лоханок и мочеточников (Lamb, 1998). Контрастные исследования, такие как экскреторный урограмма или более современные методы, такие как компьютерная томография или магнитно-резонансная томография с контрастом, могут предоставить дополнительную информацию о проходимости мочевой системы и наличии аномалий (Ohlerth & O'Brien 2007, Chang et al., 2011, Fonseca-Matheus et al., 2011, Schmidt et al., 2012). Читатель обращается к нескольким отличным обзорам изображений почек и мочевых путей для получения дополнительной информации (Rivers & Johnston 1996, Lamb 1998, Debruyn et al., 2012).
Системное измерение артериального давления при CvRD
Заявление 10: Поскольку почки и сердце являются двумя органами, находящимися под угрозой повреждения, вызванного системной гипертензией и поскольку заболевание почек часто связано с системной артериальной гипертензией, системное артериальное давление следует систематически контролировать как при почках, так и в сердечно-сосудистых заболеваниях. (Хороший консенсус, средний рейтинг, 8, диапазон, 5-9)Это заявление достигло хорошего консенсуса. Одно из наиболее хорошо описанных взаимодействий между почками и сердечно-сосудистой системой включает их интимные роли в регуляции артериального давления. АГ представляет собой лучший пример механизма, с помощью которого могут встречаться CvRDH, CvRDK и CvRDO. Поскольку гипертония отрицательно влияет на обе системы органов, измерение артериального давления обычно рекомендуется пациентам с заболеваниями почек или сердечно-сосудистой системы и читателю сообщается несколько отличных обзоров относительно измерения артериального давления у собак и кошек (Brown et al., 2007, Syme 2011 , Stepien 2014). АГ также обычно ассоциируется с заболеваниями, отличными от заболеваний почек, такими как гиперадренокортицизм, гиперальдостеронизм, феохромоцитома, гипертиреоз, гипотиреоз, сахарный диабет и собачья акромегалия (Brown et al., 2007). АГ также ассоциируется с некоторыми терапевтическими агентами, такими как глюкокортикоиды, минералокортикоиды, эритропоэтин и фенилпропаноламин (Brown et al., 2007). АГ также может быть вызванным стрессом (например, гипертензией белого халата) или может возникать в отсутствие другого идентифицируемого заболевания (то есть идиопатической, первичной или «существенной» гипертензии) (Belew et al., 1999, Marino et al., 2011). Как и у людей, АГ у собак и кошек является потенциальной причиной необратимых поражений сердечной, сосудистой, реноваскулярной, глазной и центральной нервной системы. Систолическое давление > 160 мм рт. ст. указывает на прогрессирующий риск повреждения конечного или целевого органа (International Renal Interest Society 2014). Что касается почечной собаки, АГ может привести к увеличению частоты почечных повреждений, протеинурии, снижению СКФ, увеличению частоты уремического кризиса и ухудшению смертности. (Jacobs et al., 2003). У кошек причинно-следственная связь между гипертонией и заболеванием почек менее ясна. Известно, что гипертония является фактором риска протеинурии, которая, в свою очередь, является фактором риска для ухудшения состояния почек (Syme et al., 2006, Jepson et al., 2007, Chakrabarti et al., 2012). В коррелятивном исследовании лабораторных переменных и патологических поражений в почках кошек с ХЗП протеинурия ассоциировалась с интерстициальным фиброзом и гипертрофией гломерулярного аппарата, тогда как более высокое усредненное по времени систолическое артериальное давление было связано с гломерулосклерозом и гиперпластическим артериосклерозом (Chakrabarti et al., 2013) , Сердечно-сосудистое повреждение, вторичные по отношению к АГ, хорошо восприняты у людей (Frohlich et al., 1992, Drazner, 2011) и включают концентрацию гипертрофии левого желудочка, аритмию, кровоизлияние, фиброз сосудов и миокарда и ремоделирование, развитие аортальной недостаточности, в основном диастолическую, но также систолическую дисфункцию и сердечную недостаточность. Контролируемые исследования отсутствуют у собак и кошек, но в наблюдательных исследованиях были описаны несколько гипертрофических структур левого желудочка (Snyder et al., 2001, Chetboul et al., 2003, Henik et al., 2004, Carlos Sampedrano et al., 2006), изменение левых желудочковая гипертрофия с контролем артериального давления (Snyder et al., 2001), ретинопатия сетчатки (Maggio et al., 2000), аортальная диссекция и аортальная недостаточность, связанные с проксимальной дилатацией аорты (Wey & Atkins 2000, Misbach et al., 2011) и сердечной недостаточностью (Wey & Atkins 2000, Chetboul et al., 2003). Кроме того, исследования двумерного тканевого доплеровского изображения показали, что АГ у кошек и собак ассоциируется с диастолической и, в меньшей степени, систолической дисфункцией, независимо от наличия гипертрофии миокарда (Carlos Sampedrano et al., 2006, Misbach et al., 2011).
Сообщаемая распространенность АГ у собак и кошек с ХЗП значительно варьируется в зависимости от выбранной популяции, стадии заболевания почек и применяемой методики измерения артериального давления, но ХЗП, несомненно, присутствует в значительном проценте населения, подверженного риску АГ ( Brown et al., 2007). АГ оценивается у 60-90% собак и 20-65% кошек с заболеваниями почек (Stepien 2014). Связь АГ с заболеванием митрального клапана у собак не полностью понята, и артериальное давление изменяется по стадии заболевания (Petit et al., 2013). Минимальная база данных у животных с АГ должна включать ОКА, панель биохимии сыворотки, концентрацию тироксина в сыворотке крови, анализ мочи и абдоминального ультразвука (Brown et al., 2007). Реализация эндокринных или других вторичных причин АГ может потребовать дополнительных анализов, специфичных для конкретного заболевания.
Болезни, которые вызывают системную гипотензию, также могут вызывать повреждение почек и сердечно-сосудистой системы. Гипотония, из-за сильного истощения объема, низкого сердечного выброса или коллапса системного сосудистого сопротивления, уменьшает перфузию тканей и СКФ и активирует неадекватные нейрогормональные реакции (Morales et al., 2002). Системная гипотензия, определяемая как систолическое давление <90 мм рт. ст., была связана с острой сердечной недостаточностью, возникающей у 16% собак и кошек во время госпитализации (Goutal et al., 2010). В исследовании собак с заболеванием митрального клапана систолическое АД было обратно коррелировано с клинической серьезностью заболевания. Это указывает на то, что для сосудистых осложнений, связанных с сердечной недостаточностью и / или лечения (гипотензия). Повреждение почек произойдет, если гипотензия достаточно серьезная, чтобы произвести почечную недостаточную перфузию. (Petit et al., 2013). Лечение АГ обсуждается под руководством CvRD.
Контроль CvRD
Лечение CvRD является сложной задачей, поскольку лечение заболеваний почек часто зависит от флюидной терапии и пристального внимания к количеству и качеству потребления белка и фосфора (Roudebush et al., 2010, Monaghan et al., 2012, Polzin 2013). В отличие от этого, животные с сердечной недостаточностью обычно подвергаются диуретической терапии и получают белковые добавки, особенно у лиц с признаками застоя (отек легких или выделения жидкости в третье пространство) и / или сердечной кахексии соответственно (Atkins et al., 2009, Borgarelli & Haggstrom 2010). Также важным для управления CvRD является понимание тенденции развития азотемии у животных, получающих диуретики, преимущества и риски иАПФ в установлении одновременных заболеваний почек и сердечно-сосудистых заболеваний и потенциальное влияние АГ на обе системы органов (Nicolle et al., 2007, Atkins et al., 2009, Brewer et al., 2012). Таким образом, как сердце, так и почки страдают от аномального объема внутрисосудистой жидкости, системного артериального давления и обычно применяемых методов лечения, таких как диуретики, вазодилататоры и дополнительные введения жидкости, используемые для устранения этих дисбалансов. Эти факторы потенциально влияют на взаимодействие между этими двумя системами органов (DeFrancesco 2008).
Клиническая постановка и лечение сердечной недостаточности (Borgarelli et al., 2001, Atkins et al., 2009, Ferasin 2009, Atkins & Haggstrom 2012, DeFrancesco 2013), AKI и CKD (Lees et al., 2005, Roudebush et al., 2010, Polzin 2011, 2013, Ross 2011, Vaden 2011, Bartges 2012, Monaghan и др. 2012). Короче говоря, сердечная недостаточность - это состояние, при котором больное сердце не может обеспечить адекватный сердечный выброс или может сделать это только при повышенном венозном давлении и риске перегрузки (Colluci & Braunwald 2005).
Лечение острой и хронической ХСН связано с использованием диуретиков, включая фуросемид и гидрохлоротиазид (Atkins et al., 2009, Goutal et al., 2010, Atkins & Haggstrom, 2012); вазодилататоры, включая иАПФ (Atkins et al., 2009, Goutal et al., 2010, Atkins & Haggstrom 2012), амлодипин (Quinones et al., 1996, Snyder et al., 2001), дилтиазем (Gelzer et al., 2009), нитроглицерин, гидралазин и нитропруссид (Atkins 2001, Atkins & Haggstrom, 2012); нейрогормональные блокирующие агенты, включая иАПФ, спиронолактон (Atkins et al., 2009) и бета-блокаторы, такие как атенолол и пропранолол (Rush et al., 2002, Goutal et al., 2010); и положительные инотропы, такие как дигоксин, добутамин и пимобендан (Atkins et al., 2009, Goutal et al., 2010, MacGregor et al., 2011, Atkins & Haggstrom, 2012). ОПН и ХБП - это условия, при которых больная почка не может адекватно выделять продукты метаболизма и поддерживать объем жидкости и баланс электролитов, приводя к аномалиям объема крови и электролитного обмена, азотемии и клиническим признакам уремии, когда они тяжелы.
Лечение ОПН и ХБП включает в себя комбинацию парентеральных жидкостей, редкое использование диуретиков для лечения объемной перегрузки и гиперкалиемии, антигипертензивных средств, иАПФ, желудочно-кишечных защитных средств, подщелачивающих агентов, эритропоэз-стимулирующих агентов, фосфатных связующих и диетической корректировки. Ключевым аспектом лечения как ОПН, так и ХБП является поддержание адекватного внутрисосудистого объема и давления, чтобы обеспечить достаточную перфузию почек, избегая при этом перегрузки жидкостью и дисбаланса электролитов. Напротив, основной целью лечения ХСН является снижение внутрисосудистого объема и гидростатического давления за счет использования диуретиков и других методов разгрузки. Таким образом, для болезней сердца и почек необходимо восстановить и поддерживать нормальный баланс жидкости, что часто является особенно сложным аспектом терапии (DeFrancesco 2008).
Фармакологическое лечение сердечно-сосудистых и почечных заболеваний способствует CvRD. Чрезмерное снижение объема сосудов при ХСН или чрезмерное увеличение объема сосудов в случаях ОПН или ХБП может приводить к неблагоприятным эффектам в другой органной системе. Достижение правильного баланса, конечно, сложнее, когда сердце и почки являются сопутствующими дисфункциональными. Лечение CvRD включает в себя признание и одновременную, частую оценку тонких изменений функции почек или сердца и понимание того, как патофизиология одного заболевания может взаимодействовать и влиять на функцию другого. Важным аспектом управления CvRD является лечение первичной причины клинических признаков при попытке свести к минимуму клинически значимое ухудшение функции другого органа. Руководящие принципы для CvRD почти исключительно основаны на теории и мнениях экспертов, поскольку клинические испытания, характерные для CvRD, отсутствуют.
Управление CvRDH
Заявление 11: Нестабильный CvRDH, например, в случаях острой ХСН, обычно требует госпитализации для восстановления или улучшения сердечной функции и для облегчения застойных или признаков низкого сердечного выброса, одновременно оценивая риск дисфункции почек. Стандартная острая ХСН-терапия, включающая диуретики, иАПФ, вазодилататоры и положительные инотропы, возможно, потребуется скорректировать на основе частой оценки гидратации, биомаркеров почек, электролитов, артериального давления, массы тела и выделения мочи. (Сильный консенсус, средний рейтинг, 8, диапазон, 8-9)
Это заявление достигло решительного консенсуса. В случаях CVRDH терапевтическая фоздействие мало, так как использование диуретиков и иАПФ может оказывать неблагоприятное воздействие на почечную функцию и чрезмерно агрессивный диурез с чрезмерным обезвоживанием следует избегать. Стратегии минимизации развития азотемии при лечении острой ХСН включают снижение общей суточной дозы (доза и / или частота введения) парентеральных диуретиков, использование венозных или артериальных сосудорасширяющих средств для увеличения сокращения преднагрузки и послеоперационной нагрузки и использования пимобендана или внутривенного введения добутамин для увеличения сердечного выброса и перфузии почек. Небольшая часть клиницистов удерживает или сводит к минимуму использование иАПФ во время стационарного лечения острого ХСН, так как дегидратация, вызванное мочегонным действием, может увеличить риск индуцированного иАПФ почечного повреждения (Atkins et al., 2009). Если иАПФ удерживаются или удаляются во время острой фазы, они обычно вводятся после первоначального эпизода острого ХСН, и животное лечится на дому. В случаях значительного истощения объема (повторное) введение диуретиков или иАПФ должно происходить только после улучшения состояния гидратации животного или рецидива клинических признаков застоя. Одна потенциальная терапевтическая стратегия, включающая различные иАПФ, такие как эналаприл, беназеприл, рамиприл и имидаприл, представляет собой введение дозы в нижнем конце рекомендуемого диапазона с последующей оценкой состояния гидратации и функции почек до принятия решения о титровании любого препарата к более высокому концу диапазона дозировки. Для таких пациентов всегда должен предоставляться свободный доступ к воде, если только рвота или уменьшенный психический статус не диктует иное. У сильно дегидратированных животных или у пациентов с существенной азотемией или уремией после диуретической терапии следует тщательно вводить внутривенные или подкожные жидкости с учетом содержания натрия и калия в конкретной жидкости. Использование кормовых добавок следует учитывать у животных с анорексией, чтобы обеспечить как питание, так и отсутствие натрия без гидратации. Анти-альдостероновые агенты, такие как спиронолактон, часто назначают в хронических фазах лечения ХСН (Bernay et al., 2010), и потенциал для дополнительных благоприятных эффектов, таких как уменьшение ремоделирования сердца, почек и сосудов у пациентов с CvRD, заслуживает дальнейшего исследования ( Ovaert et al., 2010). Концентрации калия в сыворотке следует тщательно контролировать, особенно когда спиронолактон используется в сочетании с иАПФ или при почечной дисфункции.
Контроль CvRDK
Заявление 12: Нестабильный CvRDK, например, в случаях острого повреждения почек (ОПН), обычно требует госпитализации для улучшения функции почек и восстановления баланса жидкости и электролитов, одновременно оценивая риск сердечной дисфункции. В дополнение к стандартному управлению ОПН особое внимание должно быть направлено на 1) соответствующее текучее, мочегонное и / или антигипертензивное лечение на основе состояния гидратации; эти методы лечения направлены на восстановление и поддержание нормального баланса жидкости и артериального давления, предотвращая перегрузку натрия и жидкости и 2) переоценку одновременных сердечных препаратов и возможную корректировку дозировки. (Сильный консенсус, средний рейтинг, 8, диапазон, 7-9)
Это заявление достигло решительного консенсуса. Это соглашение основывается на клинических опытах авторов, в которых мочегонное использование признается обоюдоострым мечом, спасая жизни, уменьшая застой, но, наоборот, злоупотребляет кашляющими собаками или одышками кошек с риском развития ОПН. Поскольку диагноз ХСН может быть скрытым, эти домашние животные могут подвергаться диурезу надлежащим образом, когда страдают от ХСН, или ненадлежащим образом, когда нет. Авторы также отмечают, что сильные петлевые диуретики, обычно фуросемид, иногда назначают при слишком высоких дозах в течение длительного времени, с вредным высыханием сурфактанта дыхательных путей и / или ухудшением азотемии.
В случаях с клинически значимым обезвоживанием, парентеральная замещения жидкости часто предоставляется в целях восстановления надлежащего баланса жидкости и производства мочи у пациентов без сердечной недостаточности. Даже при отсутствии клинических признаков сердечной недостаточности необходимо внимательно следить за добавлением жидкости, чтобы избежать осаждения скопления и прекращения, если отмечаются респираторные признаки или если увеличение веса становится чрезмерным. В случаях, когда появляются признаки чрезмерной гидратации и перегрузки, введение жидкости следует прекратить и рассмотреть вопрос о добавлении диуретиков.
Пациенты с CvRDK могут потребовать осторожного и поэтапного подхода к замещению или поддержанию жидкости путем выбора типа жидкости, относительно низкого содержания натрия, наряду с тщательным контролем массы тела, частоты дыхания и усилия, артериального давления и развития яремного венозного переполнения или асцита. Было показано, что частота дыхания > 40 вдохов в минуту является чувствительным индикатором раннего застоя в легких (отек) (Schober et al., 2010, Ohad et al., 2013, Ljungvall et al., 2014). Непреднамеренная перегрузка жидкости повышает нагрузку на сердечно-сосудистую систему и повышает риск перегрузки. За исключением случаев системной гипотензии, допамин не указывается для лечения ОПН из-за отсутствия доказанной эффективности и потенциальных побочных эффектов, таких как ухудшение функции почек, аритмий и синусовой тахикардии. (Chertow et al., 1996, Lauchske et al., 2006, Wohl et al., 2007). Использование методов заместительной заместительной терапии почек (таких как гемодиализ и ультрафильтрация), которые позволяют тонко контролировать внутрисосудистый объем в CvRDK, интригует (Acierno 2011, Cowgill 2011, Eatroff et al., 2012), но требует дополнительного изучения.
Важные аспекты управления всеми формами CvRD
Заявление 13: В дополнение к конкретным стратегиям управления для CvRDH или CvRDK особое внимание должно быть направлено на управление любой формой CvRD: 1) идентификация и лечение повышенного кровяного давления согласно рекомендациям IRIS; 2) ступенчатое титрование доз диуретиков, иАПФ, инотропов и / или жидкостей с частым контролем функции почек, массы тела, гидратации, состояния электролитов и системного артериального давления (т. е. выполняется и перепроверяется в течение 3-5 дней после начала или корректировки дозы из этих препаратов); 3) правильное питание в отношении уменьшенного в диете натрия и фосфатов и соответствующего белка и потребления калорий. (Сильный консенсус, средний рейтинг, 8, диапазон, 8-9)
Это заявление достигло решительного консенсуса. У собак и кошек с CvRD целью является поддержание систолического артериального давления <160 мм рт.ст. в попытке предотвратить или свести к минимуму повреждение органа-мишени (International Renal Interest Society 2014). При повышении кровяного давления до уровня выше 160 мм рт.ст. риск повреждения органов-мишеней увеличивается и рекомендуется лечение с указанием или без признаков повреждения органов-мишеней. Как у собак, так и у кошек эксперты защищают тезис о диетическом ограничении натрия с одновременной фармакологической терапией (Brown et al., 2007, Международное общество по интересам почек 2014). У собак терапией первого выбора является иАПФ, который титруется, чтобы влиять на мониторинг функции почек. У кошек первой терапией выбора является блокатор кальциевых каналов амлодипин (International Renal Interest Society 2014). В случаях рефрактерной АГ используется комбинированная терапия и АПФ и амлодипином, которая полезна для обоих видов патологии. Измерение системного артериального давления у собак и кошек требует пристального внимания к оборудованию и технике. Это и более подробное описание терапии является предметом нескольких отличных обзоров (Brown et al., 2007, Syme 2011, Stepien 2014).
У животных с любой формой CvRD поэтапные изменения в диуретиках или введению жидкости выполняются с осторожностью и с одновременным контролем гидратации, почечной функции и отдыхающей частоты дыхания. Ветеринары обычно вводят внутривенные или подкожные жидкости собакам и кошкам с анорексией, с заболеваниями мочевых путей и во время анестезии в попытке сохранить гидратацию и перфузию почек. В то время как потенциально полезно, введение жидкости должно выполняться с осторожностью, используя малые натриевые парентеральные жидкости или безсистемную энтеральную гидратацию через питающую трубку, особенно перед лицом основной или сопутсующей болезни сердца. Любая тип введения жидкости может ускорять ХСН или гипертонический кризис, если вводится слишком быстро или в чрезмерных объемах. Во время лечения ветеринары и, по возможности, владельцы должны следить за почечной функцией животного, скоростью и усилением дыхания, потреблением пищи и воды, массой тела и выработкой мочи. Изменения этих параметров часто сигнализируют о значительных изменениях состояния гидратации, ухудшении состояния болезни или необходимости корректировки лекарств. В случаях тяжелой CvRD, при которой трудно достичь баланса в лечении, следует рассмотреть направление в ветклинику.
Другим важным последствием CvRD является изменение фармакокинетики и фармакодинамики лекарств из-за нарушения функции сердца или почек. Например, фуросемид требует активной секреции через проксимальные почечные тубулярные клетки, чтобы достичь просвета и места его связывания со-транспортера, так что снижение перфузии почек или канальцевого повреждения снижает ожидаемый диуретический ответ (Rose et al., 1976). Сердечные препараты, в основном выводимые почками, такие как дигоксин, эналаприл и атенолол, могут потребовать корректировки дозы у животных с ОПН или ХБП (Fleet et al., 2014, Kitagawa et al., 2000, Merrett 2000, Quinones 1996, Toutain 2000). У пациентов с CvRD и метаболическим ацидозом или гипопротеинемией, возможно, необходимо отрегулировать дозы препаратов, которые связаны с высоким содержанием белка, такие как пимобендан или дигоксин. Наконец, дозы лекарств могут меняться по ряду других причин. Кардиальная кахексия может привести к снижению требований к дозировке, поскольку объем распределения или связывание с белком лекарственного средства изменяется, что требует тщательной модификации лекарственной дозы с прогрессированием заболевания (Freeman 2012). Аналогичным образом, аномальный катаболизм белков у пациентов с дегидратацией может увеличить концентрации BUN в сыворотке, ухудшая азотемию. У животных с персистирующей скоплением жидколсти с наличием асцита или плеврального выпота, который изменяет объем распределения лекарственного средства и дозирование на сухую массу тела.
Обеспечение правильного питания является важным компонентом управления CvRD. Умеренные диеты, ограниченные натрием, подходят как для почек, так и для сердечно-сосудистых заболеваний, а также уменьшенные диеты с ограничением фосфора имеют важное значение при заболевании почек (Rush et al., 2000, Atkins et al., 2009, Polzin 2011). Как уже упоминалось ранее, собаки с хроническим заболеванием сердца могут потерять мышечную массу и кондициюе тела, тем самым подтвердив, что адекватное потребление белка и калорий является важной целью. У животных с CvRD эта потребность является сбалансированной благодаря пагубному влиянию высокого потребления белка на азотемию; поэтому было бы полезно тщательное диетическое планирование при поддержке ветеринарного диетолога или терапевта. Диетические добавки, такие как жирные кислоты омега-3, иногда используются у животных с CvRD (Freeman et al., 1998, Smith et al., 2007, Roudebush et al., 2010, Polzin 2011), как антиоксиданты, так и стимуляторы аппетита, но их безопасность и эффективность не были продемонстрированы в клинических исследованиях (Lenox & Bauer, 2013).
ВЫВОД
Хотя все еще не достаточно информации, но растет число данных, свидетельствующие о том, что патологические состояния, CRS и CvRD, соответственно, могут иметь важное значение как для человека, так и для животных. Хотя некоторые аспекты CvRD явно существуют у собак и кошек, существование других является просто теоретическим. Очевидно, что многое предстоит сделать для выявления, доказательства и понимания этого вопроса. Это консенсусное заявление предназначено для повышения осведомленности и модификации определения, классификации и средств идентификации и предоставления предварительной информации об управлении CvRD. Кроме того, эта рукопись направлена на стимулирование и обеспечение основы для исследований и коммуникации в CvRD и поощрение совместных исследований с участием кардиологов и нефрологов.
Консенсусная группа CRS состоит из разнообразной группы экспертов по ветеринарной кардиологии и нефрологии, усилия которой привели к 11 (из 13 предложенных) консенсусных заявлений CvRD для собак и кошек. Авторы рекомендуют, чтобы этот консенсусный документ был изменен, поскольку имеется новая информация о CvRD. Во время дискуссий и обсуждений авторы постоянно напоминали, что сердце, сосуды и почка неумолимо связаны не только анатомически, но и по принципам на основе физиологии, патологии и клиники и что рассмотрение одной сердечно-сосудистой-почечной оси - это большая заслуга. Авторы надеются, что эта рукопись стимулирует интерес; продвигает знание CvRD, его существование и важность; и в конечном итоге способствует способности ветеринаров успешно управлять собаками и кошками с этим или подверженным риску.
Модифицированная методология Delphi, используемая для формирования консенсуса и разработки руководящих принципов для CvRD, обеспечила официальный, предсказуемый и объективный подход для этого проекта. Этот метод или другие подобные ему заслуживают рассмотрения для разработки будущих консенсусных заявлений для ветеринарной медицины.
Конфликт интересов
Ни один из авторов этой статьи не имеет финансовых или личных отношений с другими людьми или организациями, которые могли бы ненадлежащим образом повлиять или уклониться от содержания статьи. Однако проект спонсировался Vétoquinol и авторы получили компенсацию за свои усилия.
Рекомендации
- Acierno MJ. Continuous renal replacement therapy in dogs and cats. The Veterinary Clinics of North America, Small Animal Practice. 2011;41:135–146.
- Atkins CE. In: Cardiac manifestations of systemic and metabolic disease. In: Textbook of Canine and Feline Cardiology. 2nd edn. Fox PR, Sisson DA, Moise NS, editors. Philadelphia, PA, USA: W.B. Saunders; 1999. pp. 757–793.
- Atkins CE. 2001. pp. 115–116. Hypertension: the heart as a target organ. Proceedings of the American College of Veterinary Internal Medicine Forum. Denver, USA, June 15 to 18.
- Atkins CE, Häggström J. Pharmacologic management of myxomatous mitral valve disease in dogs. Journal of Veterinary Cardiology. 2012;14:165–184.
- Atkins C, Bonagura J, Ettinger S, et al. Guidelines for the diagnosis and treatment of canine chronic valvular heart disease. Journal of Veterinary Internal Medicine. 2009;23:1142–1150
- Bagshaw SM, Hoste EA, Braam B, et al. Cardiorenal syndrome type 3: pathophysiologic and epidemiologic considerations. Contributions to Nephrology. 2013;182:137–157.
- Bartges JW. Chronic kidney disease in dogs and cats. The Veterinary Clinics of North America. Small Animal Practice. 2012;42:669–692.
- Beardow AW, Buchanan JW. Chronic mitral valve disease in cavalier King Charles spaniels: 95 cases (1987–1991) Journal of the American Veterinary Medical Association. 1993;203:1023–1029.
- Belew AM, Barlett T, Brown SA. Evaluation of the white-coat effect in cats. Journal of Veterinary Internal Medicine. 1999;13:134–142.
- Bernay F, Bland JM, Haggstrom J, et al. Efficacy of spironolactone on survival in dogs with naturally occurring mitral regurgitation caused by myxomatous mitral valve disease. Journal of Veterinary Internal Medicine. 2010;24:331–341.
- Biomarkers Definitions Working Group. Biomarkers and surrogate endpoints: preferred definitions and conceptual framework. Clinical Pharmacology and Therapeutics. 2001;69:89–95.
- Bock JS, Gottlieb SS. Cardiorenal syndrome: new perspectives. Circulation. 2010;121:2592–2600
- Borgarelli M, Haggstrom J. Canine degenerative myxomatous mitral valve disease: natural history, clinical presentation and therapy. The Veterinary Clinics of North America. Small Animal Practice. 2010;40:651–663.
- Borgarelli M, Tarducci A, Tidholm A, et al. Canine idiopathic dilated cardiomyopathy. Part II: pathophysiology and therapy. Veterinary Journal. 2001;162:182–195
- Boswood A, Dukes-McEwan J, Loureiro J, et al. The diagnostic accuracy of different natriuretic peptides in the investigation of canine cardiac disease. The Journal of Small Animal Practice. 2008;49:26–32.
- Braam B, Joles JA, Danishwar AH, et al. Cardiorenal syndrome – current understanding and future perspectives. Nature Reviews Nephrology. 2014;10:48–55.
- Brewer R, Wang M, Zhang K, et al. A canine model of chronic heart failure and renal insufficiency (cardiorenal syndrome) Journal of the American College of Cardiology. 2012;S59:E969–E975.
- Brown S, Atkins C, Bagley R, et al. Guidelines for the identification, evaluation, and management of systemic hypertension in dogs and cats. Journal of Veterinary Internal Medicine. 2007;21:542–558
- Buchanan JW. Causes and prevalence of cardiovascular disease. In: Kirk RW, Bonagura JD, editors. Current Veterinary Therapy XI: Small Animal Practice. Philadelphia, PA, USA: WB Saunders; 1992. pp. 647–654.
- Carlos SampedranoC, Chetboul V, Gouni V, et al. Systolic and diastolic Myocardial dysfunction in cats with hypertrophic cardiomyopathy or systemic hypertension. Journal of Veterinary Internal Medicine. 2006;20:1106–1115.
- Chakrabarti S, Syme HM, Elliott J. Clinicopathological variables predicting progression of azotemia in cats with chronic kidney disease. Journal of Veterinary Internal Medicine. 2012;26:275–281
- Chakrabarti S, Syme HM, Brown CA, et al. Histomorphometry of feline chronic kidney disease and correlation with markers of renal dysfunction. Veterinary Pathology. 2013;50:147–155.
- Chalhoub S, Langston C, Eatroff A. Anaemia of renal disease: what it is, what to do and what's new? Journal of Feline Medicine and Surgery. 2011;13:629–640.
- Chang J, Kim S, Jung J, et al. Assessment of glomerular filtration rate with dynamic computed tomography in normal Beagle dogs. Journal of Veterinary Science. 2011;12:393–399
- Chertow GM, Sayegh MH, Allgren RL, et al. Is the administration of dopamine associated with adverse or favorable outcomes in acute renal failure? Auriculin Anaritide Acute Renal Failure Study Group. The American Journal of Medicine. 1996;101:49–53.
- Chetboul V. Advanced techniques in echocardiography in small animals. The Veterinary Clinics of North America. Small Animal Practice. 2010;40:529–543.
- Chetboul V, Tissier R. Echocardiographic assessment of canine degenerative mitral valve disease. Journal of Veterinary Cardiology. 2012;14:127–148.
- Chetboul V, Lefebvre HP, Pinhas C, et al. Spontaneous feline hypertension: clinical and echocardiographic abnormalities, and survival rate. Journal of Veterinary Internal Medicine. 2003;2003(17):89–95.
- Cobrin AR, Blois SL, Kruth SA, et al. Biomarkers in the assessment of acute and chronic kidney diseases in the dog and cat. The Journal of Small Animal Practice. 2013;54:647–655.
- Colluci WS. Pathophysiology of heart failure. In: Zipes DP, Libby P, Bonow RO, Braunwald E, Braunwald E, editors. Heart Disease: A Textbook of Cardiovascular Medicine. 7th edn. Philadelphia, PA, USA: Elsevier Saunders; 2005. pp. 509–538.
- Connolly DJ. Natriuretic peptides: the feline experience. The Veterinary Clinics of North America. Small Animal Practice. 2010;40:559–570.
- Costanzo MR, Guglin ME, Saltzberg MT, et al. Ultrafiltration versus intravenous diuretics for patients hospitalized for acute decompensated heart failure. Journal of the American College of Cardiology. 2007;49:675–683
- Cowgill LD. Urea kinetics and intermittent dialysis prescription in small animals. The Veterinary Clinics of North America. Small Animal Practice. 2011;41:193–225.
- Daure E, Belanger MC, Beauchamp G, et al. Elevation of neutrophil gelatinase-associated lipocalin (NGAL) in non-azotemic dogs with urinary tract infection. Research in Veterinary Science. 2013;95:1181–1185.
- De Loor J, Daminet S, Smets P, et al. Urinary biomarkers for acute kidney injury in dogs. Journal of Veterinary Internal Medicine. 2013;27:998–1010.
- Debruyn K, Haers H, Combes A, et al. Ultrasonography of the feline kidney: technique, anatomy and changes associated with disease. Journal of Feline Medicine and Surgery. 2012;14:794–803
- DeFrancesco TC. Maintaining fluid and electrolyte balance in heart -failure. The Veterinary Clinics of North America. Small Animal Practice. 2008;38:727–45
- DeFrancesco TC. Management of cardiac emergencies in small animals. The Veterinary Clinics of North America. Small Animal Practice. 2013;43:817–842.
- DeFrancesco TC, Rush JE, Rozanski EA, et al. Prospective clinical evaluation of an ELISA B-type natriuretic peptide assay in the diagnosis of congestive heart failure in dogs presenting with cough or dyspnea. Journal of Veterinary Internal Medicine. 2007;21:243–250.
- Detweiler DK, Patterson DF. The prevalence and types of cardiovascuar disease in dogs. Annals of the New York Academy of Sciences. 1965;127:481–516.
- Drazner MH. Progression of hypertensive heart disease. Circulation. 2011;123:327–334.
- Dupont M, Mullens W, Tang WH. Impact of systemic venous congestion in heart failure. Current Heart Failure Reports. 2011;8:233–241.
- Eatroff AE, Langston CE, Chalhoub S, Poeppel K, Mitelberg E. Long-term outcome of cats and dogs with acute kidney injury treated with intermittent hemodialysis: 135 cases (1997–2010) Journal of the American Veterinary Medical Association. 2012;241:1471–1478
- El-Refai M, Krivospitskaya O, Peterson EL, et al. Relationship of loop diuretic dosing and acute changes in renal function during hospitalization for heart failure. Journal of Experimental Cardiology. 2011;2:1000164. doi: 10.4172/2155-9880.1000164.
- Ettinger SJ, Benitz AM, Ericsson GF, et al. Effects of enalapril maleate on survival of dogs with naturally acquired heart failure. The Long-Term Investigation of Veterinary Enalapril (LIVE) Study Group. Journal of the American Veterinary Medical Association. 1998;213:1573–1577.
- Felker GM, Lee KL, Bull DA, et al. Diuretic strategies in patients with acute decompensated heart failure. New England Journal of Medicine. 2011;364:797–805
- Ferasin L. Feline myocardial disease 2: diagnosis, prognosis and clinical management. Journal of Feline Medicine and Surgery. 2009;11:183–194
- Fleet JL, Weir MA, McArthur E, et al. Kidney function and population-based outcomes of initiating oral atenolol versus metoprolol tartrate in older adults. American Journal of Kidney Diseases. 2014;64:883–891
- Fleming JM, Creevy KE, Promislow DE. Mortality in North American dogs from 1984 to 2004: an investigation into age-, size-, and breed-related causes of death. Journal of Veterinary Internal Medicine. 2011;25:187–198
- Fonfara S, Loureiro J, Swift S, et al. Cardiac troponin I as a marker for severity and prognosis of cardiac disease in dogs. Veterinary Journal. 2010;184:334–339.
- Fonseca-Matheus JM, Perez-Garcia CC, Ginja MM, et al. Contrast-enhanced dynamic magnetic resonance nephrography in healthy dogs. Veterinary Journal. 2011;189:341–345
- Francis GS, Benedict C, Johnstone DE. Comparison of neuroendocrine activation in patients with left ventricular dysfunction with and without congestive heart failure. A substudy of the Studies Of Left Ventricular Dysfunction (SOLVD) Circulation. 1990;82:1724–1729
- Freeman LM. Cachexia and sarcopenia: emerging syndromes of importance in dogs and cats. Journal of Veterinary Internal Medicine. 2012;26:3–17
- Freeman LM, Rush JE, Kehayias JJ, et al. Nutritional alterations and the effect of fish oil supplementation in dogs with heart failure. Journal of Veterinary Internal Medicine. 1998;12:440–448.
- Frohlich ED, Apstein C, Chobanian AV, et al. The heart in hypertension. New England Journal of Medicine. 1992;327:998–1008.
- Gelzer AR, Kraus MS, Rishniw M, et al. Combination therapy with digoxin and diltiazem controls ventricular rate in chronic atrial fibrillation in dogs better than digoxin or diltiazem monotherapy: a randomized crossover study in 18 dogs. Journal of Veterinary Internal Medicine. 2009;23:499–508
- Givertz MM, Massie BM, Tara K, Fields TK, et al. The effects of KW-3902, an adenosine a1-receptor antagonist, on diuresis and renal function in patients with acute decompensated heart failure and renal impairment or diuretic resistance. Journal of the American College of Cardiology. 2007;50:1551–1560.
- Gouni V, Chetboul V, Pouchelon JL, et al. Azotemia in cats with feline hypertrophic cardiomyopathy: prevalence and relationships with echocardiographic variables. Journal of Veterinary Cardiology. 2008;10:117–123.
- Goutal CM, Keir I, Kenney S, et al. Evaluation of acute congestive heart failure in dogs and cats: 145 cases (2007–2008) Journal of Veterinary Emergency and Critical Care. 2010;20:330–337.
- Guazzi M, Gatto P, Giusti G, et al. Pathophysiology of cardiorenal syndrome in decompensated heart failure: role of lung-right heart-kidney interaction. International Journal of Cardiology. 2013;169:379–384.
- Guglielmini C, Diana A, Pietra M, et al. Use of the vertebral heart score in coughing dogs with chronic degenerative mitral valve disease. The Journal of Veterinary Medical Science. 2009;71:9–13
- Haase M, Muller C, Damman K, et al. Pathogenesis of cardiorenal syndrome type 1 in acute decompensated heart failure: workgroup statements from the eleventh consensus conference of the Acute Dialysis Quality Initiative (ADQI) Contributions to Nephrology. 2013;182:99–116.
- Haggstrom J, Boswood A, O'Grady M, et al. Effect of pimobendan or benazepril hydrochloride on survival times in dogs with congestive heart failure caused by naturally occurring myxomatous mitral valve disease: the QUEST study. Journal of Veterinary Internal Medicine. 2008;22:1124–1135
- Hanna EB, Deschamps EH. Acute heart failure: acute cardiorenal syndrome and role of aggressive decongestion. Clinical Cardiology. 2014;37:773–778.
- Harison E, Langston C, Palma D, et al. Acute azotemia as a predictor of mortality in dogs and cats. Journal of Veterinary Internal Medicine. 2012;26:1093–1098.
- Haute Autorité de Santé 2010. Recommandations par consensus formalisé (RCF) Méthode d'élaboration de recommandations de bonne pratique.
- Henik RA, Stepien RL, Bortnowski HB. Spectrum of M-mode echocardiographic abnormalities in 75 cats with systemic hypertension. Journal of the American Animal Hospital Association. 2004;40:359–363.
- Hezzell MJ, Boswood A, Chang YM, et al. The combined prognostic potential of serum high-sensitivity cardiac troponin I and N-terminal pro-B-type natriuretic peptide concentrations in dogs with degenerative mitral valve disease. Journal of Veterinary Internal Medicine. 2012;26:302–311
- Hou FF, Zhang X, Zhang GH, et al. Efficacy and safety of benazepril for advanced chronic renal insufficiency. New England Journal of Medicine. 2006;354:131–140.
- International Renal Interest Society. Iris Guidelines. 2014. http://www.iris-kidney.com/guidelines/. Accessed April 11, 2013.
- International Small Animal Cardiac Health Council. Recommendations for diagnosis of heart disease and treatment of heart failure in small animals. In: Fox PR, Sisson DD, Moise NS, editors. Textbook of Canine and Feline Cardiology. Philadelphia, PA, USA: WB Saunders; 1999. pp. 883–901.
- IRIS Canine GN Study Group Diagnosis Subgroup. Littman MP, Daminet S, et al. Consensus recommendations for the diagnostic investigation of dogs with suspected glomerular disease. Journal of Veterinary Internal Medicine. 2013;27:S19–26
- Jackevicius C, Fan CS, Warner A. Clinical outcomes of erythropoietin use in heart failure patients with anemia of chronic kidney disease. Journal of Cardiac Failure. 2014;20:327–333.
- Jacobs F, Polzin D, Osborne CA, et al. Association between initial systolic blood pressure and risk of developing a uremic crisis or of dying in dogs with chronic renal failure. Journal of the American Veterinary Association. 2003;222:322–329.
- Jepson RE, Elliott J, Brodbelt D, et al. Effect of control of systolic blood pressure on survival in cats with systemic hypertension. Journal of Veterinary Internal Medicine. 2007;21:402–409.
- Jose P, Skali H, Anavekar N, et al. Increase in creatinine and cardiovascular risk in patients with systolic dysfunction after myocardial infarction. Journal of the American Society of Nephrology. 2006;17:2886–2891.
- Kai K, Yamaguchi T, Yoshimatsu Y, et al. Neutrophil gelatinase-associated lipocalin, a sensitive urinary biomarker of acute kidney injury in dogs receiving gentamicin. The Journal of Toxicological Sciences. 2013;38:269–277.
- Kellihan HB, Oyama MA, Reynolds CA, et al. Weekly variability of plasma and serum NT-proBNP measurements in normal dogs. Journal of Veterinary Cardiology. 2009;11:S93–S97.
- Kitagawa H, Eguchi T, Kitoh K, et al. Plasma concentrations of an angiotensin-converting enzyme inhibitor, benazepril, and its active metabolite, benazeprilat, after repeated administrations of benazepril in dogs with experimental kidney impairment. Journal of Veterinary Medical Science. 2000;62:179–186.
- Lalor SM, Connolly DJ, Elliott J, et al. Plasma concentrations of natriuretic peptides in normal cats and normotensive and hypertensive cats with chronic kidney disease. Journal of Veterinary Cardiology. 2009;11:S71–S79.
- Lamb CR. Ultrasonography of the ureters. The Veterinary Clinics of North America. Small Animal Practice. 1998;28:823–848.
- Langhorn R, Willesen JL, Tarnow I, et al. Evaluation of a high-sensitivity assay for measurement of canine and feline serum cardiac troponin I. Veterinary Clinical Pathology. 2013;42:490–498.
- Lantis AC, Atkins CE, DeFrancesco TC, et al. Effects of furosemide and the combination of furosemide and the labeled dosage of pimobendan on the circulating renin-angiotensin-aldosterone system in clinically normal dogs. American Journal of Veterinary Research. 2011;72:1646–1651.
- Lauschke A, Teichgräber UK, Frei U, et al. ‘Low-dose’ dopamine worsens renal perfusion in patients with acute renal failure. Kidney International. 2006;69:1669–1674.
- Lazzarini V, Bettari L, Bugatti S, et al. Can we prevent or treat renal dysfunction in acute heart failure? Heart Failure Review. 2012;17:291–303.
- Lees GE, Brown SA, Elliott J, et al. Assessment and management of proteinuria in dogs and cats: 2004 ACVIM Forum Consensus Statement (small animal) Journal of Veterinary Internal Medicine. 2005;19:377–385.
- Lenox CE, Bauer JE. Potential adverse effects of omega-3 Fatty acids in dogs and cats. Journal of Veterinary Internal Medicine. 2013;27:217–226.
- Liang KV, Williams AW, Greene EL, et al. Acute decompensated heart failure and the cardiorenal syndrome. Critical Care Medicine. 2008;36:S75–S88.
- Litster AL, Buchanan JW. Vertebral scale system to measure heart size in radiographs of cats. Journal of the American Veterinary Medical Association. 2000;216:210–214.
- Ljungvall I, Rishniw M, Porciello F, et al. Sleeping and resting respiratory rates in healthy adult cats and cats with subclinical heart disease. Journal of Feline Medicine and Surgery. 2014;16:281–290
- Lord PF, Hansson K, Carnabuci C, et al. Radiograhic heart size and its rate of increase as tests for onset of congestive heart failure in cavalier king charles spaniels with mitral valve regurgitation. Journal of Veterinary Internal Medicine. 2011;25:1312–1319
- MacDougall DF, Cook T, Steward AP, et al. Canine chronic renal disease: prevalence and types of glomerulonephritis in the dog. Kidney International. 1986;29:1144–1151.
- MacDonald JS, Bagdon WJ, Chennekatu P, et al. Renal effects of enalapril in the dog. Kidney International. 1987;31:S148–S153.
- MacGregor JM, Rush JE, Laste NJ, et al. Use of pimobendan in 170 cats (2006–2010) Journal of Veterinary Cardiology. 2011;13:251–260.
- Maddens B, Heiene R, Smets P, et al. Evaluation of kidney injury in dogs with pyometra based on proteinuria, renal histomorphology, and urinary biomarkers. Journal of Veterinary Internal Medicine. 2011;25:1075–1083.
- Maggio F, DeFrancesco TC, Atkins CE, et al. Ocular lesions associated with systemic hypertension in cats: 69 cases (1985–1998) Journal of the American Veterinary Medical Association. 2000;217:695–702
- Mall G, Huther W, Schneider J, et al. Diffuse intermyocardiocytic fibrosis in uraemic patients. Nephrology, Dialysis, Transplantation. 1990;5:39–44
- Marino CL, Cober RE, Iazbik MC, Couto CG. White-coat effect on systemic blood pressure in retired racing greyhounds. Journal of Veterinary Internal Medicine. 2011;25:861–865
- Maschio G, Alberti D, Janin G, et al. Effect of the angiotensin-converting–enzyme inhibitor benazepril on the progression of chronic renal insufficiency. New England Journal of Medicine. 1996;334:939–945
- McCullough PA, Kellum JA, Haase M, et al. Pathophysiology of the cardiorenal syndromes: executive summary from the eleventh consensus conference of the Acute Dialysis Quality Initiative (ADQI) Contributions to Nephrology. 2013;182:82–98.
- Mehta RL, Rabb H, Shaw AD, et al. Cardiorenal syndrome type 5: clinical presentation, pathophysiology and management strategies from the eleventh consensus conference of the Acute Dialysis Quality Initiative (ADQI) Contributions to Nephrology. 2013;182:174–194.
- Merrett D. Digoxin therapy. Australian Veterinary Journal. 2000;78:612–615.
- Misbach C, Gouni V, Tissier R, et al. Echocardiographic and tissue Doppler imaging alterations associated with spontaneous canine systemic hypertension. Journal of Veterinary Internal Medicine. 2011;25:1025–1035.
- Mitani S, Yabuki A, Taniguchi K, et al. Association between the intrarenal renin-angiotensin system and renal injury in chronic kidney disease of dogs and cats. The Journal of Veterinary Medical Science. 2013;75:127–133.
- Miyagawa Y, Tominaga Y, Toda N, et al. Relationship between glomerular filtration rate and plasma N-terminal pro B-type natriuretic peptide concentrations in dogs with chronic kidney disease. Veterinary Journal. 2013;197:445–450.
- Monaghan K, Nolan B, Labato M. Feline acute kidney injury: 2. Approach to diagnosis, treatment and prognosis. Journal of Feline Medicine and Surgery. 2012;14:785–793.
- Monti P, Benchekroun G, Berlato D, et al. Initial evaluation of canine urinary cystatin C as a marker of renal tubular function. The Journal of Small Animal Practice. 2012;53:254–259.
- Morales DL, Kavarana MN, Helman DN, et al. Restoration of renal function in shock by perfusion of the renal artery with venous blood: a counterintuitive approach. Critical Care Medicine. 2002;30:1297–1300.
- Much WE, Wilcox CS. Disorders of body fluids, sodium and potassium in chronic renal failure. American Journal of Medicine. 1982;72:536–550.
- Mullens W, Abrahams Z, Francis GS, et al. Importance of venous congestion for worsening of renal function in advanced decompensated heart failure. Journal of the American College of Cardiology. 2009;53:589–596.
- Nicolle AP, Chetboul V, Allerheiligen T, et al. Azotemia and glomerular filtration rate in dogs with chronic valvular disease. Journal of Veterinary Internal Medicine. 2007;21:943–949.
- Ohad DG, Rishniw M, Ljungvall I, et al. Sleeping and resting respiratory rates in dogs with subclinical heart disease. Journal of the American Veterinary Medical Association. 2013;243:839–843.
- Ohlerth S, O'Brien RT. Contrast ultrasound: general principles and veterinary clinical applications. Veterinary Journal. 2007;174:501–512.
- Ovaert P, Elliott J, Bernay F, et al. Aldosterone receptor antagonists – how cardiovascular actions may explain their beneficial effects in heart failure. Journal of Veterinary Pharmacology and Therapeutics. 2010;33:109–117.
- Oyama MA, Sisson DD. Cardiac troponin-I concentration in dogs with cardiac disease. Journal of Veterinary Internal Medicine. 2004;18:831–839.
- Oyama MA, Boswood A, Connolly DJ, et al. Clinical usefulness of an assay for measurement of circulating N-terminal pro-B-type natriuretic peptide concentration in dogs and cats with heart disease. Journal of the American Veterinary Medical Association. 2013;243:71–82.
- Pallazzuoli A, Gallota M, Iovine F, et al. Anaemia in heart failure: a -common interaction with renal insufficiency called the cardio-renal anemia syndrome. International Journal of Clinical Practice. 2008;62:281–286.
- Petit AM, Gouni V, Tissier R, et al. Systolic arterial blood pressure in small-breed dogs with degenerative mitral valve disease: a prospective study of 103 cases (2007–2012) Veterinary Journal. 2013;197:830–835.
- Polzin DJ. Chronic kidney disease in small animals. The Veterinary Clinics of North America. Small Animal Practice. 2011;41:15–30.
- Polzin DJ. Evidence-based step-wise approach to managing chronic kidney disease in dogs and cats. Journal of Veterinary Emergency and Critical Care. 2013;23:205–215.
- Potter LR, Yoder AR, Flora DR, et al. Natriuretic peptides: their structures, receptors, physiologic functions and therapeutic applications. Handbook of Experimental Pharmacology. 2009;191:341–366.
- Quinones M, Dyer DC, Ware WA, et al. Pharmacokinetics of atenolol in normal cats. American Journal of Veterinary Research. 1996;57:1050–1053.
- Reynolds CA, Brown DC, Rush JE, et al. Prediction of first onset of congestive heart failure in dogs with degenerative mitral valve disease: the PREDICT cohort study. Journal of Veterinary Cardiology. 2012;14:193–202.
- Riesen SC, Kovacevic A, Lombard CW, et al. Prevalence of heart disease in symptomatic cats: an overview from 1998 to 2005. Schweizer Archiv fur Tierheilkunde. 2007;149:65–71.
- Rivers BJ, Johnston GR. Diagnostic imaging strategies in small animal nephrology. The Veterinary Clinics of North America. Small Animal Practice. 1996;26:1505–1517.
- Ronco C, Di Lullo L. Cardiorenal syndrome. Heart failure clinics. 2014;10:251–280.
- Ronco C, Haapio M, House AA, et al. Cardiorenal syndrome. Journal of the American College of Cardiology. 2008;52:1527–1539.
- Ronco C, McCullough P, Anker SD, et al. Cardio-renal syndromes: report from the consensus conference of the acute dialysis quality initiative. European Heart Journal. 2010;31:703–711.
- Rose HJ, Pruitt AW, McNay JL. Effect of experimental azotemia on renal clearance of furosemide in the dog. The Journal of Pharmacology and Experimental Therapeutics. 1976;196:238–247.
- Ross L. Acute kidney injury in dogs and cats. The Veterinary clinics of North America. Small Animal Practice. 2011;41:1–14.
- Ross S. Clinical progression of early chronic renal failure and implications for management. In: August J, Osborne C, editors. Consultations in Feline Internal Medicine. St. Louis, MO, USA: Elsevier; 2006. pp. 389–402.
- Rossi G, Giordano A, Breda S, et al. Big-endothelin 1 (big ET-1) and homocysteine in the serum of dogs with chronic kidney disease. Veterinary Journal. 2013;198:109–115.
- Roudebush P, Polzin DJ, Adams LG, et al. An evidence-based review of therapies for canine chronic kidney disease. The Journal of Small Animal Practice. 2010;51:244–252.
- Rush JE, Freeman LM, Brown DJ, et al. Clinical, echocardiographic, and neurohormonal effects of a sodium-restricted diet in dogs with heart failure. Journal of Veterinary Internal Medicine. 2000;14:513–520.
- Rush JE, Freeman LM, Fenollosa NK, et al. Population and survival characteristics of cats with hypertrophic cardiomyopathy: 260 cases (1990–1999) Journal American Veterinary Medical Association. 2002;220:202–207.
- Schmidt MK, Reynolds CA, Estrada AH, et al. Effect of azotemia on serum N-terminal proBNP concentration in dogs with normal cardiac function: a pilot study. Journal of Veterinary Cardiology. 2009;11:S81–S86.
- Schmidt DM, Scrivani PV, Dykes NL, et al. Comparison of glomerular filtration rate determined by use of single-slice dynamic computed tomography and scintigraphy in cats. American Journal of Veterinary Research. 2012;73:463–469.
- Schrier RW, Wang W, Poole B, Mitra A. Acute renal failure: definitions, diagnosis, pathogenesis, and therapy. Journal of Clinical Investigation. 2004;114:5–14. doi: 10.1172/JCI200422353.
- Schober KE, Hart TM, Stern JA, et al. Detection of congestive heart failure in dogs by Doppler echocardiography. Journal of Veterinary Internal Medicine. 2010;24:1358–1368.
- Segev G, Palm C, LeRoy B, et al. Evaluation of neutrophil gelatinase-associated lipocalin as a marker of kidney injury in dogs. Journal of Veterinary Internal Medicine. 2013;27:1362–1367
- Sharkey LC, Berzina I, Ferasin L, et al. Evaluation of serum cardiac troponin I concentration in dogs with renal failure. Journal of the American Veterinary Medical Association. 2009;234:767–770.
- Silverberg DS, Wexler D, Iaina A, et al. The interaction between heart failure and other heart diseases, renal failure, and anemia. Seminars in Nephrology. 2006;26:296–306.
- Sjostrand K, Wess G, Ljungvall I, et al. Breed differences in natriuretic peptides in healthy dogs. Journal of Veterinary Internal Medicine. 2014;28:451–457.
- Smith CE, Freeman LM, Rush JE, et al. Omega-3 fatty acids in Boxer dogs with arrhythmogenic right ventricular cardiomyopathy. Journal of Veterinary Internal Medicine. 2007;21:265–273.
- Snyder PS, Sadek D, Galin L, et al. Effect of amlodipine on echocardiographic variables in cats with systemic hypertension. Journal of Veterinary Internal Medicine. 2001;15:52–56.
- Steimle AE, Stevenson LW, Chelimsky-Fallick C, et al. Sustained hemodynamic efficacy of therapy tailored to reduce filling pressure in survivors with advanced heart failure. Circulation. 1997;96:1165–1172.
- Stepien RL. Systemic Hypertension. In: Bonagura JD, Twedt DC, editors. Current Veterinary Therapy XV. St. Louis, MO, USA: Elsevier Sauders; 2014. pp. 726–730.
- Surman S, Couto CG, Dibartola SP, et al. Arterial blood pressure, proteinuria, and renal histopathology in clinically healthy retired racing greyhounds. Journal of Veterinary Internal Medicine. 2012;26:1320–1329.
- Syme H. Hypertension in small animal kidney disease. The Veterinary Clinics of North America. Small Animal Practice. 2011;41:63–89.
- Syme HM, Markwell PJ, Pfeifer D, Elliott J. Survival of cats with naturally occurring chronic renal failure is related to severity of proteinuria. Journal of Veterinary Internal Medicine. 2006;20:528–535.
- Testani JM, McCauley BD, Chen J, et al. Clinical characteristics and outcomes of patients with improvement in renal function during the treatment of decompensated heart failure. Journal of Cardiac Failure. 2011;17:993–1000.
- The BENCH Study Group. The effect of benazepril on survival times and clinical signs of dogs with congestive heart failure: results of a multicenter, prospective, randomized, double-blinded, placebo-controlled, long term clinical trial. Journal of Veterinary Cardiology. 2008;6:7–18.
- Thomas WP, Gaber CE, Jacobs GJ, et al. Recommendations for standards in transthoracic two-dimensional echocardiography in the dog and cat. Echocardiography Committee of the Specialty of Cardiology, American College of Veterinary Internal Medicine. Journal of Veterinary Internal Medicine. 1993;7:247–252.
- Toutain P-L, Levebvre H, LaRoute V. New insights on effect of kidney insufficiency on disposition of angiotensin-converting enzyme inhibitors: case of enalapril and benazepril in dogs. The Journal of Pharmacology and Experimental Therapeutics. 2000;292:1094–1103.
- Tumlin JA, Costanzo MR, Chawla LS, et al. Cardiorenal syndrome type 4: insights on clinical presentation and pathophysiology from the eleventh consensus conference of the Acute Dialysis Quality Initiative (ADQI) Contributions to Nephrology. 2013;182:158–173.
- Tvarijonaviciute A, Ceron JJ, Martinez-Subiela S, et al. Serum and urinary adiponectin in dogs with renal disease from leishmaniasis. The Veterinary Record. 2012;171:297.
- Vaden SL. Glomerular disease. Topics in Companion Animal Medicine. 2011;26:128–134.
- Vallon V, Miracle C, Thomson S. Adenosine and kidney function: potential implications in patients with heart failure. European Journal of Heart Failure. 2008;10:176–187.
- Wehner A, Hartmann K, Hirschberger J. Associations between proteinuria, systemic hypertension and glomerular filtration rate in dogs with renal and non-renal diseases. The Veterinary Record. 2008;162:141–147.
- Wey AC, Atkins CE. Aortic dissection and congestive heart failure associated with systemic hypertension in a cat. Journal of Veterinary Internal Medicine. 2000;14:208–213.
- Wilson HE, Jasani S, Wagner TB, et al. Signs of left heart volume overload in severely anaemic cats. Journal of Feline Medicine and Surgery. 2010;12:904–909.
- Wohl JS, Schwartz DD, Flournoy WS, et al. Renal hemodynamic and diuretic effects of low-dosage dopamine in anesthetized cats. Journal of Veterinary Emergency and Critical Care. 2007;17:45–52.
^Наверх









