Осуществимость, безопасность и толерантность подкожного введения синтетического собачьего натрийуретического пептида B-типа (syncBNP) у здоровых собак и собак с заболеванием митрального клапана стадии B1

Информация об авторах
Oyama M.A., Solter P.F., Thorn C.L., Stern J.A. Feasibility, safety, and tolerance of subcutaneous synthetic canine B-type natriuretic peptide (syncBNP) in healthy dogs and dogs with stage B1 mitral valve disease // J Vet Cardiol. 2017 Jun;19(3):211-217.
Абстракт
ВВЕДЕНИЕ: Важным аспектом сердечной недостаточности является прогрессирующая неэффективность спасительной натрийуретической пептидной системы и его вторичного эффектра 3 ', 5'-циклического гуанозинмонофосфата (цГМФ) . У людей с острой сердечной недостаточностью введение экзогенного натрийуретического пептида связано с улучшением клинических признаков и снижением сердечного давления. Это исследование предназначалось для определения осуществимости, толерантности и безопасности подкожного (SC) синтетического собачьего натриуретического пептида B-типа (syncBNP) у собак.
ЖИВОТНЫЕ: Шесть частных собак.
МАТЕРИАЛЫ И МЕТОДЫ: Собаки были зарегистрированы в модифицированном исследовании 3 + 3 фазы I. Три собаки первоначально получали дозы 2,5 и 5 мкг / кг SC syncBNP с последующим добавлением трех собак, дозированных 5 и 10 мкг / кг. Гемодинамический мониторинг проводился в течение 120 минут после каждой инъекции. Образцы крови и мочи собирали через 45 и 120 минут после инъекции 5 мкг / кг. Основные неблагоприятные клинические события, которые могли бы остановить тестирование, были заранее определены.
РЕЗУЛЬТАТЫ: Были завербованы четыре здоровые собаки и две собаки с заболеванием митрального клапана стадии B1. Синтетический натрийуретический пептид типа B хорошо переносился во всех дозах. Натриуретический пептид синтетического собачьего B-типа при 5 мкг / кг значительно увеличивал медианный плазменный цГМФ (базовый цГМФ, 131,5 пмоль / мл [диапазон, 91,9-183,6 пмоль / мл], 45 мин, 153,6 пмоль / мл [140,3-214,3 пмоль / мл ], 120 мин, 192,7 пмоль / мл [139,1-240,1 пмоль / мл], p = 0,041).
ОБСУЖДЕНИЕ И ВЫВОДЫ: Мы сообщаем о первом назначения синтетического мозгового натрийуретического пептидома с лечебной целью у частных собак. Подкожное назначение syncBNP была осуществимой, хорошо переносимой, безопасной и повышенной плазменной цГМФ. Дальнейшие исследования, использующие экзогенную синхронизацию для лечения сердечных заболеваний, оправданы.
Застойная сердечная недостаточность (ХСН) связана с дисрегуляцией неагрегативных нейрогормональных систем таких как ангиотензин альдостерон ренин системы (РААС) в сочетании с неэффективностью спасительных систем, такие как система натрийуретических пептидов [1]. Натриуретический пептид B-типа (BNP) представляет собой натрийуретический, мочегонный, сосудорасширяющий и антиремоделирующий гормон, который продуцируется клетками миокарда в ответ на сердечную недостаточность из-за множество основных причин, включая патологию митрального клапана (МВД) [2,3]. Натриуретический пептид B-типа секретируется миокардиоцитами как неактивный прогормон, который требует ферментативной конверсии к его активной форме, 32-аминокислотный пептид [2].
Активный BNP связывается с натрийуретическими пептидными рецепторами и через своего вторичного посланника 30, 50 -циклического гуанозинмонофосфата (cGMP), BNP противодействует эффектам активации RAAS в сердце, почках и сосудистой системы [4]. По мере развития болезни сердца спасительные эффекты эндогенного BNP постепенно затупляется, приводя к резистентности BNP ' [5,6]. Сопротивление связано с неэффективной конверсией BNP от неактивной до активной формы, увеличения оформления активной формы и понижающее регулирование натрийуретического пептидного рецептора, среди других возможных механизмов [5]. Одна стратегия борьбы с резистентностью BNP - введение экзогенного активного BNP. У пациентов с острой ХСН, внутривенная инфузия BNP является дополнительным средством для уменьшения одышки, давления заклинивания легочных капилляров и среднего артериального давления и увеличения сердечного выброса, объема мочи и экскреции натрия мочой [7,8]. У собак с экспериментальной ХСН, экзогенный BNP увеличил плазменный цГМФ, уменьшил левое предсердие и среднее системное артериальное давление и увеличенный объем экскреции натрия мочой [9,10]. По мнению авторов, назначение экзогенного BNP собакам в клинических ветеринарных условиях не сообщалось.
Мы стремились выполнить эскалацию дозы фазы 1 исследование, чтобы в первую очередь проверить осуществимость, толерантность и безопасность подкожной (SC) инъекции синтетических собачьих BNP (syncBNP) у здоровых собак и у собак с начальными стадиями эндокардиоза. Вторичная цель исследование состояло в сборе пилотных данных о влиянии syncBNP на плазменном цГМФ, функцию почек и РААС.
Животные, материалы и методы
Частные собаки, представленные на прием в Ветеринарную Больницу Университета Пенсильвании, а также как собаки, принадлежащие сотрудникам, преподавателям и студентам, клиника была проспективно завербована.
Основной целью исследования фазы 1 является «испытание нового препарата в небольшой группе. впервые оценить его безопасность, определения безопасного диапазона дозы и идентифицировать побочные эффекты ». Учитывая неопределенность безопасности у собак с продвинутой ХСН, мы решили привлекать здоровых собак и собак с эхокардиографическим доказательства стадии B1 (то есть доклинических) эндокардиоза [11] в этом первоначальном исследовании.
Критерий исключения включал вес тела <8,0 кг, систолическое давление крови <120 мм рт.ст., история ХСН, терапия с диуретиками, пимобенданом или амлодипином в прошлом за 14 дней, креатинин сыворотки > 3,0 мг / дл или одновременное течение системного или сердечно-сосудистого заболевания клинически важными исследованиями. Приемлемые собаки подверглись базовому скринингу, который включал измерение креатинина сыворотки, азота мочевины, концентрация фосфора, натрия и калия и удельного веса мочи, креатинин и концентрация натрия, непрямое измерение систолического давления крови с использованием метода Допплера, электрокардиограммы с шестью отведениями, и снятие эхокардиограммы.
В исследовании использовалась модифицированная эскалация дозы 3 þ 3, последовательная, одноручная и открытая маркировка [12], которые последовательно тестировали две когорты предметов, каждый из которых содержит три человека, в дозе тестовой статьи. Основываясь на предыдущих исследованиях экспериментальной сердечной недостаточности у собак [10,13], целевая доза была установлена на уровне 5 мг / кг подкожно syncBNP.
Начальным трем собакам вводили более низкую дозу 2,5 мг / кг SC syncBNP с последующими измерениями частоты сердечных сокращений и систолического артериального давления в течение 10, 30, 60, 90 и 120 мин после инъекции. При отсутствие каких-либо серьезных неблагоприятных событий, собаки, были подвергнуты 2-часовому периоду вымывания, за которым следовала вторая инъекция 5 мг / кг SC syncBNP. Гемодинамический мониторинг затем повторялся над другими 120 мин. Основные неблагоприятные события достаточно серьезные, чтобы остановить исследование, были предварительно определены и включала следующее: системное систолическое давление крови <100 мм рт.ст., частота сердечных сокращений > 180 ударов в минуту (уд / мин) в течение> 1 мин, пока собака была в состоянии покоя, сердечные аритмии классифицируются как неожиданные, клинически значимые или вызывающие гемодинамический компромисс основанные на оценке исследователя, обморок или коллапс, непереносимость активности, определяемая как слабость мышц, которая значительно ограничена или влияют на способность подниматься, стоять или перемещаться. Так долго поскольку никаких серьезных побочных эффектов не произошло ни в одном из первых три собаки, получающие 2,5 и 5 мг / кг п/к syncBNP, вторая когорта из трех полученных собак 5 мг / кг SC syncBNP в качестве начальной дозы, затем 10 мг / кг подкожно синтетического мозгового натрийуретического пептида в качестве второй дозы. С помощью этих методов, толерантность к низкой дозе могут быть оценены у трех собак до получения всех шести собак средняя доза и введение самого высокого доза у трех собак будет иметь место только в том случае, если две более низкие дозы хорошо переносятся.
SyncBNP получали в виде инъекционных аликвот путем разбавления флаконов, содержащих 200 мг лиофилизированного syncBNPe, с 1 мл стерильного лактированного раствора Рингера. Раствор фильтровали через 0,2 мм шприц-фильтр перед инъекцией для обеспечения стерильности. Инъекции проводили в течение 10 минут после приготовления раствора. Питьевая вода была предоставлена ad libitum всем собакам в ходе учебных процедур. Во всех шести собаках кровь (5 мл) и образцы мочи собирали через 45 и 120 мин после инъекции 5 мг / кг syncBNP. Плазму и сыворотку удаляли центрифугированием, и все образцы хранили при 70 ° C в течение 30 минут после сбора. Аликвоты каждого образца для концентрации альдостерона и активности ренина в плазме были отправлены в течение ночи на сухой лед в Университет штата Иллинойс, где их хранили при - 80 ° С и анализировали как партию в течение 8 недель после сбора проб. Лабораторная валидация активности ренина в плазме и анализа альдостеронов для использования с собачьей плазмой и сывороткой включала тесты на восстановление аналита, линейность результатов испытаний после последовательного разведения собачьей плазмы или сыворотки с калибратором нулевого набора и с точностью до начала теста. Активность плазмы ренина измеряли с помощью конкурентного ELISAf ангиотензина I, генерируемого в единице объема во времени (нг / мл / час). Восстановление ангиотензина I из четырех образцов у собак составляло в среднем 87,8% (диапазон = 77,5 92 92,7%). Последовательные разведения собачьей плазмы с нулевым калибратором набора до окончательного разведения 1: 8, приводили к уменьшению концентраций ангиотензина I, которые оказались линейными на основе линейного регрессионного анализа (r2 = 0,9684). Тесты с точностью до начала пробной пробы образца собачьей плазмы 12 раз за один проход дали коэффициент вариации 5,40%. Концентрацию альдостерона в сыворотке измеряли с помощью конкурентного ELISA. Восстановление альдостерона из четырех образцов сыворотки собак с шипами альдостерона составляло в среднем 97,9% (диапазон = 96,2-107,8%). Последовательные разведения собачьей сыворотки с нулевым калибратором набора до окончательного разведения 1: 8 приводили к уменьшению концентраций альдостерона, которые, по результатам регрессионного анализа, были линейными (r2 = 0,9939). В пределах пробега точность пробной сыворотки собак составляет 12 раз за один проход, что дает коэффициент вариации 2,68%. Образцы для cGMP были отправлены на сухой лед в Калифорнийский университет в Дэвисе и анализировали как партию в течение 7 месяцев после сбора образцов. Цитратная плазма и моча с cGMP концентрацией измеряли ферментным иммуноанализом которые ранее были проверены [14].
Непрерывные данные были представлены как медиана и ассортимент. Количество и тип каких-либо серьезных неблагоприятных событий были сведены в таблицу. Проведены статистические испытания используя коммерческую программу program.i
Тесты Фридмана проводились для сравнения результаты гемодинамики и нейрогормона на исходном уровне и после получения дозы 5 мг / кг syncBNP. Тесты ManneWhitney использовали для сравнения пар данных, если общий тест Фридмана был важный. Никаких поправок для нескольких сравнений. Из-за небольшого количества животных, получавших низкие и высокие дозы, не было статистически значимого различия проводились в этих дозах, а мониторинг гемодинамических данных был для защиты от нежелательных явлений (т. е. тахикардия или гипотонии). Значение было определено как р <0,05. Протокол исследования был рассмотрен и утвержден Институциональным использованием и уходом за животными Комитета Университета Пенсильвании и информированное письменное согласие было получено от всех владельцев собак.
Результаты
Две собаки на стадии B1 эндокардиоза и четыре здоровые собаки были завербованы, в том числе трое самцов, кастрированных и три самки. Собаки включали четыре смешанные породы, один кокер-спаниель и один Кинг-Чарльз Спаниель. Средний вес составлял 14,5 кг (9,0-31,7 кг), а средний возраст - 8 лет (1-15 лет). Подкожная инъекция синтетического мозгового натрийуретического пептида хорошо переносилась и не было никаких серьезных побочных эффектов у любой из собак в любой из испытуемых доз. При 2,5 мг / кг доза, базовое систолическое артериальное давление и сердцебиение в среднем составляли 127 мм рт. ст. и 116 уд / мин, соответственно. За 120-минутный период мониторинга, следующий за дозой 2,5 мг / кг, среднее систолическое артериальное давление и частота сердечных сокращений составляла 125-143 мм рт.ст. и 90-108 уд / мин, соответственно. При дозе 10,0 мг / кг, базовое систолическое артериальное давление и частота сердечных сокращений в среднем 133 мм рт.ст. и 135 уд / мин, соответственно.
В течение 120-минутного периода мониторинга, следующего за дозой 10,0 мг / кг, среднее систолическое артериальное давление и частота сердечных сокращений колебалась 113-150 mmHg и 63-80 ударов в минуту. После дозы 5 мг / кг не было значительного изменения систолического артериального давления или сердцебиений (таблица 1) или показатели активности RAAS или почек (таблица 2), однако увеличение средней концентрации в плазме cGMP через 45 и 120 мин после инъекции (исходный уровень ГМФ, 131,5 пмоль / мл [91,9-83,6 пмоль / мл]; 45 мин, 153,6 пмоль / мл [140,3-14,3 пмоль / мл]; 120 мин, 192,7 пмоль / мл [139,1-240,1 пмоль / мл]; p=0.041). Сравнение Pairwise показало, что плазменный цГМФ в течение 45 мин (p = 0,024) и 120 мин (p = 0,046) были значительно увеличены по сравнению с базовой линией (рис.1).
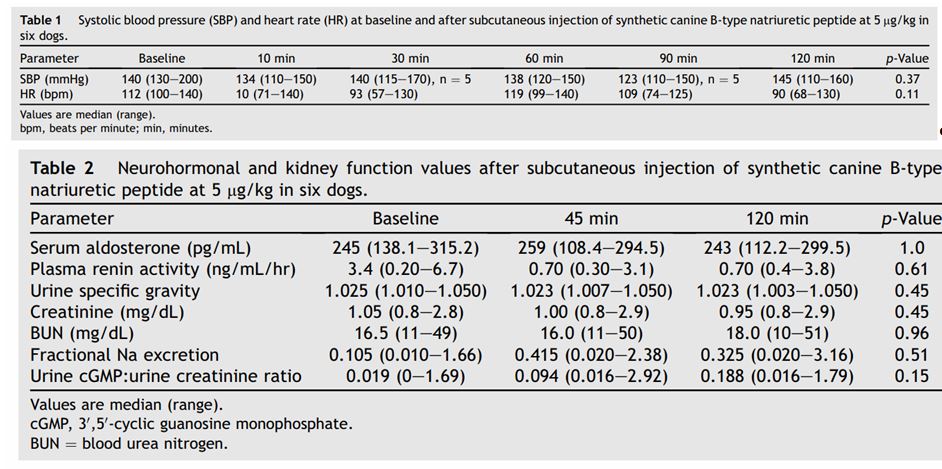
Артериального давления, ЧСС,активности RAAS и почек после введения натрийуретического пептида собакам
Обсуждение
Основная цель этого исследования заключалась в оценке осуществимости, переносимости и безопасности подкожной инъекции syncBNP . Мы продемонстрировали, что дозировка syncBNP между 2,5 и 10 мг / кг не имели острых побочных эффектов и хорошо переносится и безопасно. Таким образом, дозы в этом диапазоне являются разумными отправными точками для будущего исследования биологической активности и эффективности синтетического мозгового натрийуретического пептида у собак с более продвинутыми стадиями дегенеративного клапанного заболевания, пациентов с серьезными сопутствующими заболеваниями и собак разных пород и размеров. Вторичная цель этого исследования было собрать пилотные данные с участием маркеров биологической активности, в основном связанные с нейрогормональной активностью.
Рисунок 1 Плазменные уровни 30, 50 -циклический монофосфат гуанозина (цГМФ) была значительно увеличена по сравнению с исходным уровнем на 45 и 120 минут после подкожное введение 5 мг / кг синтетического натриуретического пептида B-типа (syncBNP)
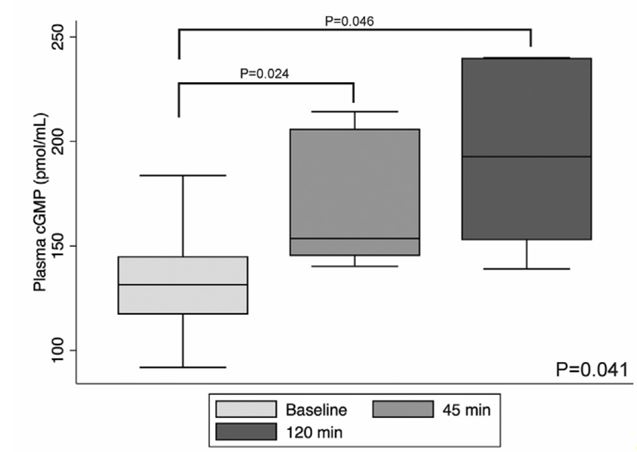
Повышенная плазма cGMP предполагает, что syncBNP был успешным при привязке и активации натрийуретических пептидных рецепторов. Мы наблюдали значительное повышение концентрации цГМФ в плазме до 120 мин после инъекции 5 мг / кг, что в соответствии с привязкой syncBNP к натрийуретическим пептидным рецепторам [15]. Эти результаты в целом согласуются с предыдущими исследованиями [10,13], где введение 5 мг / кг BNP значительно увеличивало плазменную цГМФ через 60 мин и не снижало среднее артериального давления или исход сердечной недостаточности у собак с экспериментальной сердечной недостаточностью. В предыдущее исследование [13], подкожное введение BNP уменьшало размер правого предсердия и давления заклинивания легочной системы, однако, мы не выполняли инвазивные процедуры, необходимые для сбора данных в текущем исследовании. После syncBNP введение, активность ренина в плазме уменьшилась и фракционная экскреция натрия увеличивалась, но эти изменения не были статистически значимыми, и необходимы дальнейшие исследования с лучшей организованностью. По крайней мере, одна собака в нашем исследовании имела признаки хронической почечной недостаточности в начале исследования (сывороточный креатинин, 2,8 мг / дл; удельный вес мочи, 1,013), и это возможно, повлияло на почечный ответ на syncBNP в отношении степени высвобождения ренина и экскреции натрия. Эффект BNP на активность RAAS сложный.
Можно ожидать увеличения активности ренин-ангиотензиновой и альдостероновой системы, если BNP индуцирует резкое снижение артериального давления [10], тогда как активность RAAS может быть подавлена, если BNP зависимой дезактивация приводит к улучшению гемодинамики [16]. Последний эффект был бы самым вероятным, если BNP вводится хронически [16,17]. Результаты этого исследования помогают исследование синтетического мозгового натрийуретического пептида как потенциального острого или хроническая терапия у собак с сердечными заболеваниями. цели острой терапии с использованием syncBNP в первую очередь включают диурез, натрийурез и снижение венозного давления. Разработка практических путей хронического введение пептидных соединений, таких как syncBNP также представляет интерес [18e21]. У собак, подкожные инъекции BNP обеспечивают более длительный период полувыведения и продолжительность воздействия, чем внутривенные (IV) дозы [9], и наши результаты помогают определить дозы которые может быть хроническим планом лечения подкожного введения препарата. У людей с ХСН два раза в день инъекции подкожно BNP были связаны с повышенным натрийурезом и диурезом и подавлением РААС [16,17], уменьшением массой левого желудочка и объема левого предсердия и улучшение качества жизни [17]. У экспериментальных собак SC BNP при 5 мг / кг каждые 8 ч в течение 10 дней увеличение сердечного выброса и снижение легочного давление капиллярного заклинивания [10] без развития толерантности [13].
Выводы
Появляется методика подкожного назначения синтетического мозгового натрийуретического пептида с лечебной целью для собак осуществимо, хорошо переносится и безопасно. Биологическая активность 5 мг / кг SC syncBNP была предложена увеличением концентрации цГМФ в плазме. Будущее исследования, исследующие клиническое преимущество острого и хроническое введение syncBNP у собак с сердечными заболеваниями представляют интерес.
Статья опубликована
Oyama M.A., Solter P.F., Thorn C.L., Stern J.A. Feasibility, safety, and tolerance of subcutaneous synthetic canine B-type natriuretic peptide (syncBNP) in healthy dogs and dogs with stage B1 mitral valve disease // J Vet Cardiol. 2017 Jun;19(3):211-217.
Литература
- Sisson DD. Neuroendocrine evaluation of cardiac disease. Vet Clin North Am Small Anim Pract 2004;34: 1105e26.
- Goetze JP. Biochemistry of pro-B-type natriuretic peptidederived peptides: the endocrine heart revisited. Clin Chem 2004;50:1503e10.
- Takemura N, Toda N, Miyagawa Y, Asano K, Tejima K, Kanno N, Arisawa K, Kurita T, Nunokawa K, Hirakawa A, Tanaka S, Hirose H. Evaluation of plasma N-terminal pro-brain natriuretic peptide (NT-proBNP) concentrations in dogs with mitral valve insufficiency. J Vet Med Sci 2009;71:925e9.
- Chang MS, Lowe DG, Lewis M, Hellmiss R, Chen E, Goeddel DV. Differential activation by atrial and brain natriuretic peptides of two different receptor guanylate cyclases. Nature 1989;341:68e72.
- Baerts L, Gomez N, Vanderheyden M, De Meester I, Mc Entee K. Possible mechanisms for brain natriuretic peptide resistance in heart failure with a focus on interspecies differences and canine BNP biology. Vet J 2012;194:34e9.
- Solter P. Paradoxes of natriuretic peptide therapy. Vet J 2013;195:14e5.
- Colucci WS, Elkayam U, Horton DP, Abraham WT, Bourge RC, Johnson AD, Wagoner LE, Givertz MM, Liang CS, Neibaur M, Haught WH, LeJemtel TH. Intravenous nesiritide, a natriuretic peptide, in the treatment of decompensated congestive heart failure. Nesiritide Study Group. N Engl J Med 2000;343:246e53.
- Yancy CW, Jessup M, Bozkurt B, Butler J, Casey Jr DE, Drazner MH, Fonarow GC, Geraci SA, Horwich T, Januzzi JL, Johnson MR, Kasper EK, Levy WC, Masoudi FA, McBride PE, McMurray JJ, Mitchell JE, Peterson PN, Riegel B, Sam F, Stevenson LW, Tang WH, Tsai EJ, Wilkoff BL. 2013 ACCF/ AHA guideline for the management of heart failure: executive summary: a report of the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines. Circulation 2013;128:1810e52.
- Nishida Y, Morita H, Minamino N, Kangawa K, Matsuo H, Hosomi H. Effects of brain natriuretic peptide on hemodynamics and renal function in dogs. Jpn J Physiol 1990;40: 531e40.
- Chen HH, Grantham JA, Schirger JA, Jougasaki M, Redfield MM, Burnett Jr JC. Subcutaneous administration of brain natriuretic peptide in experimental heart failure. J Am Coll Cardiol 2000;36:1706e12.
- Atkins C, Bonagura J, Ettinger S, Fox P, Gordon S, Haggstrom J, Hamlin R, Keene B, Luis-Fuentes V, Stepien R. Guidelines for the diagnosis and treatment of canine chronic valvular heart disease. J Vet Intern Med 2009;23:1142e50.
- Le Tourneau C, Lee JJ, Siu LL. Dose escalation methods in phase I cancer clinical trials. J Natl Cancer Inst 2009;101: 708e20.
- Chen HH, Schirger JA, Cataliotti A, Burnett Jr JC. Intact acute cardiorenal and humoral responsiveness following chronic subcutaneous administration of the cardiac peptide BNP in experimental heart failure. Eur J Heart Fail 2006;8:681e6.
- Stern JA, Reina-Doreste Y, Chdid L, Meurs KM. Identification of PDE5A: E90K: a polymorphism in the canine phosphodiesterase 5A gene affecting basal cGMP concentrations of healthy dogs. J Vet Intern Med 2014;28:78e83.
- Cavero PG, Margulies KB, Winaver J, Seymour AA, Delaney NG, Burnett Jr JC. Cardiorenal actions of neutral endopeptidase inhibition in experimental congestive heart failure. Circulation 1990;82:196e201.
- Chen HH, Redfield MM, Nordstrom LJ, Horton DP, Burnett Jr JC. Subcutaneous administration of the cardiac hormone BNP in symptomatic human heart failure. J Card Fail 2004;10:115e9.
- Chen HH, Glockner JF, Schirger JA, Cataliotti A, Redfield MM, Burnett Jr JC. Novel protein therapeutics for systolic heart failure: chronic subcutaneous B-type natriuretic peptide. J Am Coll Cardiol 2012;60:2305e12.
- Ahmad T, Felker GM. Subcutaneous B-type natriuretic peptide for treatment of heart failure: a dying therapy reborn? J Am Coll Cardiol 2012;60:2313e5.
- Lewis AL, Richard J. Challenges in the delivery of peptide drugs: an industry perspective. Ther Deliv 2015;6:149e63.
- Li X, Yu M, Fan W, Gan Y, Hovgaard L, Yang M. Orally active-targeted drug delivery systems for proteins and peptides. Expert Opin Drug Deliv 2014;11:1435e47.
- Malhaire H, Gimel JC, Roger E, Benoit JP, Lagarce F. How to design the surface of peptide-loaded nanoparticles for efficient oral bioavailability? Adv Drug Deliv Rev 2016;120: 320e36.
^Наверх









