Факторы риска кашля у собак с естественно приобретенным миксоматозным митральным клапаном

Ferasin L., Crews L., Biller D.S., Lamb K.E., Borgarelli M. Risk factors for coughing in dogs with naturally acquired myxomatous mitral valve disease // J Vet Intern Med. 2013 Mar-Apr;27(2):286-292.
Абстракт
ФОН: Кашель часто сообщается как основной клинический признак застойной сердечной недостаточности (ХСН) у собак с хроническим дегенеративным миксоматозным заболеванием митральным клапана (MMVD). В качестве потенциальных причин кашля у этих пациентов были предложены одновременное заболевание дыхательных путей и сжатие левого главного бронха большим левым предсердием.
ЦЕЛИ: Изучить связь между наличием кашля и различными потенциальными причинами кашля, включая ХСН, аномальной рентгенографической картиной дыхательных путей и кардиомегалией у собак, пострадавших от естественно приобретенной MMVD.
ЖИВОТНЫЕ: Двести шесть собак, принадлежащих клиенту.
МЕТОДЫ: Ретроспективный анализ, проведенный по медицинским данным собак, пораженных ММВД, которые прошли полную оценку сердца, включая эхокардиографическое исследование и торакальную рентгенографию.
РЕЗУЛЬТАТЫ: Однофазные анализы показали, что CHF не является предиктором кашля (OR = 1,369, 0,723, 2,594), тогда как аномальный рентгенографический рисунок дыхательных путей (OR = 3,650, 2,051, 6,496) и увеличенный размер левого предсердия, наблюдаемый рентгенологически (OR = 3,637, 1,904, 6,950 ) или эхокардиографически (OR = 2.553, 1.436, 4.539) были значительно связаны с кашлем у собак с MMVD. Те же факторы риска были значительными при многофакторном анализе.
ВЫВОДЫ И КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ: Это исследование показывает, что CHF не ассоциируется с кашлем у собак с MMVD. Вместо этого аномальный рентгенографический рисунок дыхательных путей и увеличение левого предсердия связаны с кашлем у этих пациентов. Этот важный вывод следует учитывать при рассмотрении диагноза и клинического лечения ХСН у этих собак.
Литература
Ferasin L., Crews L., Biller D.S., Lamb K.E., Borgarelli M. Risk factors for coughing in dogs with naturally acquired myxomatous mitral valve disease // J Vet Intern Med. 2013 Mar-Apr;27(2):286-292.
Сокращения
- Ао - аорта
- AOR - скорректированное отношение шансов
- CHF - застойная сердечная недостаточность
- DSB Дэвид С Биллер
- КСУ - Канзасский государственный университет
- LA / Ao - отношение диаметра левого предсердия и корня аорты
- LA - левое предсердие
- LC - Лаура Кривс
- LF - Лука Ферасин
- LVDd% - процентное увеличение диаметра левого желудочка в диастоле
- LVDD - Диаметр левого желудочка в диастоле
- МБ - Микеле Боргарелли
- MMVD - болезнь миксоматозного митрального клапана
- SD - стандартное отклонение
- УМН - Университет Миннесоты
- UOT - Туринский университет
- VHS оценка позвоночного размера сердца
Кашель - важная физиологическая функция, присутствующая у многих видов млекопитающих для удаления или выбрасывания вредных веществ, таких как инородные тела, слизь или обломки, из дыхательных путей и сохранения нормального здоровья дыхательных путей [1]. Кашель может быть вызван стимуляцией рецепторов кашля, локализованные в гортани, трахее или бронхах [2, 3], тогда как раздражение более мелких бронхов, бронхиол и альвеол не вызывает кашель [4]. Кроме того, просвет в потоке нижних дыхательных путей был бы слишком низким для создания достаточных сдвиговых сил для язвенная слизь и мусор из таких мест [5]. Согласно этим наблюдениям, отек легких не должен быть ожидаемой причиной кашля, если накопление жидкости не является достаточно сильным, чтобы нарастать в дыхательных путях, создавая мягкий влажный кашель, сопровождаемый мокротой, окрашенной кровью [6]. Хотя имеется зарегистрированная корреляция между потенциалами действия, генерируемыми кашлевыми рецепторами и средним давлением левого предсердия у анестезированных кроликов, прямой связи между возникающим перибронхиальным отеком и кашлем не сообщается [7]. Тем не менее, во многих ветеринарных учебниках кашель обычно связан с наличием кардиогенного отека легких у собак [8-13]. Большинство собак, которые развивают застойную сердечную недостаточность (ХСН) породы собак, пострадавших от хронической дегенеративной болезни митрального клапана (MMVD). Эта же группа пациентов также склонна к развитию сопутствующей болезни дыхательных путей (например, коллапс трахеи, бронхомаляция, хронический бронхит) [11, 14-16]. Кроме того, кардиомегалия и, в частности, расширение левого предсердия (ЛА), потенциально могут способствовать кашлю у этих пациентов механической дорзальной компрессией трахеи и бронхов. Однако, по-видимому, нет связи между увеличением размера левого предсердия и нарушениями дыхательных путей у собак [17]. Кардиомегалия, оцениваемая по шкале позвоночника (VHS), была идентифицирована как диагностический индикатор для дифференциации «сердечного кашля» от "некардиогенного кашля" на основе рентгенограмм грудной клетки [18], но точность VHS для выявления собак с эхокардиографическими данными кардиомегалии в последнее время оспаривается [17].
Исследование, специально посвященное взаимосвязи между кашлем у собак с MMVD, не было проведено для наших знаний. Поэтому целью этого исследования было исследование связи между кашлем и потенциальными причинами кашля, таких как кардиогенный отек легких (ХСН), болезнь дыхательных путей и кардиомегалия у собак, с естественно приобретенной MMVD.
Материалы и методы
Данные были собраны ретроспективно из клинических отчетов трех различных учреждений: Университета Миннесоты (УМН), Туринского университета (UOT) и Канзасского государственного университета (KSU). Выбор случая был основан на собаках, которые прошли полную диагностическую оценку сердечного шума между 2005 и 2007 гг. (УМН), 2003 и 2007 гг. (UOT), а также 2007 и 2009 гг. (KSU). Критерии включения включали окончательный диагноз MMVD, полную историю болезни и полное клиническое исследование, которое включало эхокардиографическое исследование и торакальную рентгенографию, выполненную в тот же день. Диагноз MMVD был основан на эхокардиографических доказательствах утолщенных створок митрального клапана, пролапса митрального клапана и любой степени регургитации митрального клапана, идентифицированной по цветному доплеровскому исследованию. Присутствие или отсутствие кашля, одышки или и того, и другого были основаны на наблюдении этих симптомов клиницистом во время клинического обследования или у владельца или со ссылкой на ветеринара в предыдущие несколько дней. Неполные медицинские записи, отсутствие ссылки на клинические признаки кашля и одышки, двусмысленный диагноз или сопутствующее присутствие других сердечных заболеваний считались критериями исключения. Собаки также были исключены из исследования, если они получили фуросемид, противокашлевые средства или противовоспалительные препараты в течение нескольких дней, предшествующих консультациям по кардиологии.
Эхокардиографические исследования были рассмотрены 2 сертифицированными кардиологами (LF и MB). Размер левого предсердия (LA) и диаметр корня аорты (Ao) измерялись эхокардиографически по двумерному методу, описанному Hansson et al [19], а отношение LA / Ao использовалось для определения увеличения левого предсердия (LA / AO> 1,5). Диаметр левого желудочка в диастоле (LVDd) был получен с помощью M-режима сканирования левого желудочка с правого парастернальной позиции по короткой оси. Это значение использовалось для расчета процентного увеличения LVDd (% увеличения = 100 × [(измеренный LVDd - ожидаемый нормальный LVDd) / ожидаемый LVDd]). Ожидаемый нормальный размер LVDd был рассчитан в соответствии с аллометрическим масштабированием Корнелла [20].
Радиографическая интерпретация выполнялась двумя сертифицированными радиологами (LC и DSB). Оба радиолога были ослеплены историей пациентов, результатами клинических исследований и эхокардиографической оценкой. Наличие кардиомегалии, сопровождающейся застоем венозной крови в венах легких и интерстициальной или альвеолярной картиной, считалось показателем кардиогенного отека легких (ХСН). Размер сердца измеряли по VHS на боковых проекциях, и испытуемые считались имеющими кардиомегалию, если VHS составляла более 10,7 (нормальное среднее плюс минус 2 SD = 9,7 + 1,0 = 10,7) [21]. Увеличение размера левого предсердия оценивалось субъективно на боковой проекции как дорсальное возвышение дистальной части трахеи и киля, спинное смещение левого бронха, потеря каудальной кардиальной талии с расширенной камерой, простирающейся дорзально и каудально. На дорсовентральном уровне увеличенный размер левого предсердия определялся как повышенная непрозрачность сердечного основания, вызванная суммированием увеличенной камеры и выпучиванием левой границы сердца в 2-3-часовом положении. Радиографические признаки колапса трахеи, бронхиального коллапса, бронхиальной картины и бронхоэктаза были интерпретированы как сопутствующие нарушения дыхательных путей, потенциально ответственные за кашель. Собранные данные были перенесены на электронную таблицу 1 и подтверждены 2 исследователями (LF и MB) для точности.
Статистические модели
Одномерные модели логистической регрессии использовались для оценки вероятности того, что пациент проявит кашель. Радиографическими переменными, рассматриваемыми в анализе, были кардиогенный отек легких (ХСН), увеличенный размер ЛЖ, кардиомегалия (VHS> 10,7), VHS (непрерывная переменная), бронхиальная картина, колапс трахеи, коллапс бронхов и комбинированное присутствие радиографических нарушений дыхательных путей (после этого указывается как «картина болезни дыхательных путей - все причины», которая является составной категорией, включающей любую из трех предыдущих переменных). В анализ эхокардиографических переменных были включены две непрерывные переменные (LVDd% и LA / Ao) и 2 категориальных эхокардиографических переменных (LVDd> 10% normal и LA / AO> 1,5). Возраст и вес тела анализировались как непрерывные, так и категориальные (более 8,5 лет и 8,6 кг соответственно для возраста и веса тела). Такие пороговые значения были произвольно экстраполированы из недавно опубликованного исследования, в котором показано, что собаки с коллапсом дыхательных путей были значительно старше (средний возраст, 8,5 лет) и имели более низкую массу тела (средняя масса тела, 8,6 кг) [16]. Все эти переменные называются «Конкретные переменные модели кашля» в дальнейшем.
Многомерные модели генерировались с использованием статистически значимых переменных из одномерного анализа. Были выбраны две разные многомерные модели, относящиеся к рентгенографическим (модель 1) и эхокардиографическим (модель 2) переменным, чтобы избежать потенциальной мультиколлинеарности. Кроме того, чтобы избежать коллинеарности и переобучения, из модели 1 была сохранена очень значительная картина болезни дыхательных путей (все причины) и отека легких, и в сочетании с непрерывными переменными из многомерной модели 2 для создания модели 3.
Наконец, для решения модифицирующих эффектов были созданы модели с двусторонним коррекционным взаимодействием, направленные на взаимодействие с увеличением левого предсердия (LA), которое оценивалось по рентгенографии и LA / AO> 1,5, измеренное эхокардиографически), а также наличие или отсутствие аномальных дыхательных путей шаблон. Двухстороннее скорректированное взаимодействие также использовалось для оценки взаимодействия увеличенного размера LA на грудных рентгенограммах с возрастом, измеряемым как непрерывная переменная.
Все анализы проводились с использованием SAS (2), а вероятность ошибки 1-го типа 0,05 использовалась как показатель статистической значимости.
Нолрмальные распределенные данные в результатах выражаются как среднее ± стандартное отклонение (SD), а непараметрические данные выражаются как медиана (25 - 75-й процентиль).
Результаты
В запросе базы данных было обнаружено 206 случаев собак (49,5% женщин, 50,5% мужчин) с эхокардиографически подтвержденным диагнозом MMVD, который выполнил все критерии включения. Эти собаки принадлежали 49 различным породам, среди которых наиболее часто представляли группу смешанных пород (12,9%), затем миниатюрные пудели (7,1%), йоркширские терьеры (6,7%) и кокер-спаниели (6,7%). Их средний возраст составлял 10,7 ± 2,5 года (диапазон 3,8-16,6), средний вес тела 9,0 (6,0-16,7) кг (диапазон 1,8-52,0).
Семьдесят две собаки (34,9%) были бессимптомными. У девяноста девяти собак (48,5%) наблюдалось клиническое проявления кашля, и у 27 из этих собак были радиографические данные о кардиогенном отеке легких (27,3%). Шестьдесят семь кашляющих собак имели сопутствующую радиографическую аномалию дыхательных путей (32,5%), и только 6 (6,1%) имели рентгенографические данные об отеке легких при отсутствии аномальной картины дыхательных путей. Пятнадцать собак (7,3%) имели тахипноэ или одышку, не связанные с ХСН. Наконец, у всех собак с рентгенологическими показаниями отек легких было клиническое представление, совместимое с тахипноэ или одышкой (100%), с кашлем или без него.
Размер левого предсердия был увеличен у 143 (69,4%) собак при рентгенографическом обследовании и у 124 (60,2%) при эхокардиографическом исследовании (LA / Ao> 1,5) со средним отношением LA / Ao 2,0 (1,8-2,4) (диапазон 1,51 -3,6). Кардиомегалия, интерпретированная как повышенная VHS (> 10,7), наблюдалась у 143 собак (69,4%) при рентгенографическом исследовании. Размер левого желудочка был увеличен у 140 собак (67,8%) при эхокардиографическом обследовании (LVDd> 10%). Одномерный анализ логистической регрессии состоял из 16 независимых переменных, моделирующих наличие кашля. Все специфические переменные кашля были связаны с более высокой частотой кашля, за исключением кардиогенного отека легких. Было обнаружено, что на основании рентгенографии было обнаружено, что 8 переменных (увеличенный размер левого предсердия, VHS, кардиомегалия [VHS> 10,7], бронхиальная картина, коллапс трахеи, коллапс бронхов и все причины нарушений радиографических нарушений дыхательных путей) были значительно связаны с кашлем. На основе эхокардиографии были связаны 4 переменные (LVDd%, кардиомегалия [LVDd> 10%], отношение LA / Ao и увеличенный размер левого предсердия [LA / AO> 1,5]). Наконец, как старость, так и малый вес тела были связаны с кашлем (табл. 1).
Таблица 1. Результат одномерных анализов, показывающих связь между риском развития кашля и рентгенографическими / эхокардиографическими показателями, а также сигналом у 206 собак с естественным заболеванием митрального клапана
| Параметры | Odds Ratio | Lower 95% CI | Upper 95% CI | P Value |
| Рентгенографические параметры | ||||
| Кардиогенный отек легких (CHF) | 1.369 | 0.723 | 2.594 | .3350 |
| Увеличение левого предсердия (LA) | 3.637 | 1.904 | 6.950 | <.0001 |
| VHS >10.7 | 2.653 | 1.421 | 4.955 | .0022 |
| VHS показатель | 1.658 | 1.262 | 2.179 | .0003 |
| Паттерн болезни дыхательных путей (все причины) | 3.650 | 2.051 | 6.496 | <.0001 |
| Бронхиальный паттерн | 8.776 | 2.519 | 30.579 | .0006 |
| Коллапс трахеи | 3.310 | 1.831 | 5.983 | <.0001 |
| Бронхиальный коллапс | 3.332 | 1.400 | 7.926 | .0065 |
| Эхокардиографические параметры | ||||
| LVDd >10% | 2.220 | 1.211 | 4.068 | .0099 |
| LVDd% | 1.021 | 1.008 | 1.034 | .0012 |
| Увеличение левого предсердия (LA/Ao >1.5) | 2.553 | 1.436 | 4.539 | .0014 |
| LA/Ao | 2.510 | 1.498 | 4.206 | .0005 |
| Признаки | ||||
| Пожилые собаки (>8.5 year) | 3.263 | 1.536 | 6.930 | .0021 |
| Возраст | 1.144 | 1.024 | 1.279 | .0177 |
| Маленькие собаки (вес тела <8.6 kg) | 1.795 | 1.033 | 3.115 | .0381 |
| Вес тела | 1.036 | 1.007 | 1.067 | .0156 |
CHF, застойная сердечная недостаточность; VHS, оценка позвоночного размера сердца; LVDd> 10%, процентное увеличение диаметра левого желудочка в диастоле более 10%; LVDd%, процентное увеличение диаметра левого желудочка в диастоле; LA / Ao> 1,5, соотношение диаметра левого предсердия и диаметра корня аорты более 1,5; LA / Ao диаметр левого предсердия и отношение корня аорты.
Для оценки обоснованности одномерных моделей при наличии других переменных были созданы две многомерные модели. Статистически значимым является анализ радиографических переменных с использованием моделей 1, 2 специфических переменных модели кашля (увеличенный размер ЛА и рентгенографическая характеристика аномального паттерна дыхательных путей). При оценке характеристик эхокардиографического кашля, характерных для однофакторного анализа и выраженных непрерывно (модель 2), LA / Ao оставалась значительной. Интересно отметить, что в модели 3 аномальный рентгенографический рисунок дыхательных путей (все причины) показал еще больший скорректированный коэффициент шансов (AOR), как и LA / Ao, тогда как отек легких и LVDd% показали сходные результаты (таблица 2).
Таблица 2. Многовариантные модели, относящиеся к рентгенографическим и эхокардиографическим переменным, которые были значительными в однофазных анализах, представленных в таблице 1
| Значимые переменные | Adjusted Odds Ratio | Lower 95% CI | Upper 95% CI | P Value |
| Модель 1 | ||||
| Радиографические параметры | ||||
| Кардиогенный отек легких (CHF) | 0.663 | 0.317 | 1.385 | .2739 |
| Увеличение размера левого предсердия (LA) | 3.477 | 1.605 | 7.537 | .0016 |
| VHS >10.7 | 1.462 | 0.702 | 3.046 | .3100 |
| Паттерн болезней дыхательных органов (все причины) | 3.505 | 1.905 | 6.450 | <.0001 |
| Модель 2 | ||||
| Эхокардиографические параметры | ||||
| LVDd% | 1.011 | 0.996 | 1.027 | .1501 |
| LA/Ao | 1.900 | 1.010 | 3.573 | .0463 |
| Модель 3 | ||||
| Радиографические / Эхокардиографические параметры | ||||
| Кардиогенный отек легких | 0.685 | 0.322 | 1.485 | .3267 |
| Паттерн болезней дыхательных органов (все причины) | 4.255 | 2.285 | 7.925 | <.001 |
| LVDd% | 1.015 | 0.999 | 1.032 | .692 |
| LA/Ao | 2.062 | 1.022 | 4.159 | .0432 |
VHS, оценка позвоночный размер сердца; LVDd%, процентное увеличение диаметра левого желудочка в диастоле; LA / Ao> 1,5 указывает соотношение между диаметром левого предсердия и диаметром корня аорты более 1,5.
Первый анализ 2-взаимодействия показал приблизительно 4-кратное большее отношение шансов для собак, которые представлены с рентгеноскопически увеличенным левым предсердием в присутствии аномального рентгенографического рисунка дыхательных путей, в отличие от пациентов с увеличенным левым предсердием без рентгенографически обнаруживаемого аномального рисунка дыхательных путей (рис. 1А). Аналогичное явление наблюдалось с эхокардиографическим отношением LA / AO > 1,5, для которого наблюдалось двукратное увеличение (рис. 1B). Эффект дивергентного взаимодействия может присутствовать для двух переменных, но условия взаимодействия незначительны для увеличенного LA (рентгенографического обнаружения) аномальной картиной дыхательных путей (P = .458), а также взаимодействия LA / AO> 1,5 по аномальной картине дыхательных путей (P = 0,307), предполагая, что оба этих основных эффекта могут действовать независимо друг от друга. Было проведено дополнительное взаимодействие между возрастом как непрерывной переменной и наличием или отсутствием увеличенного LA. Хотя увеличенный возраст, особенно при наличии расширенного LA (рентгенологический находка), ожидается, что он будет иметь больший AOR, взаимодействие снова было несущественным (P = .856), несмотря на значительный эффект, сообщаемый в однофакторном анализе для соответствующих переменных в таблице 1 (рис. 2).
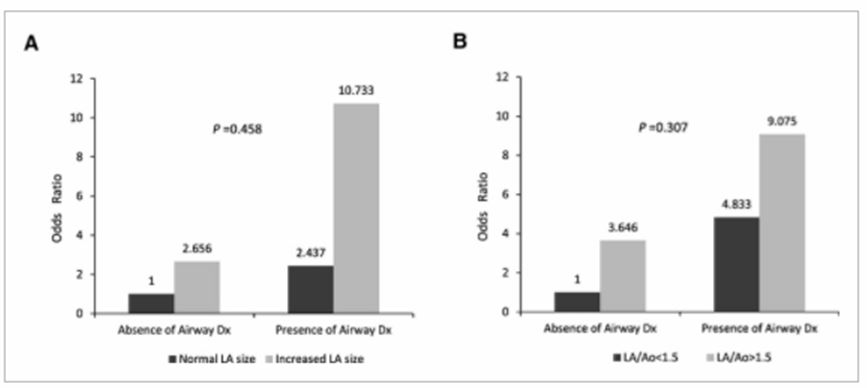
Рис 1. Взаимодействие между наличием аномального рентгенографического профиля дыхательных путей и наличием увеличения левого предсердия оценивалось рентгенографически (А) и эхокардиографически (В) для риска кашля у 206 собак с естественным заболеванием митрального клапана.
LA / Ao указывает соотношение диаметра левого предсердия и диаметра корня аорты. Оба взаимодействия не были статистически значимыми при уровне достоверности α = 0,05.
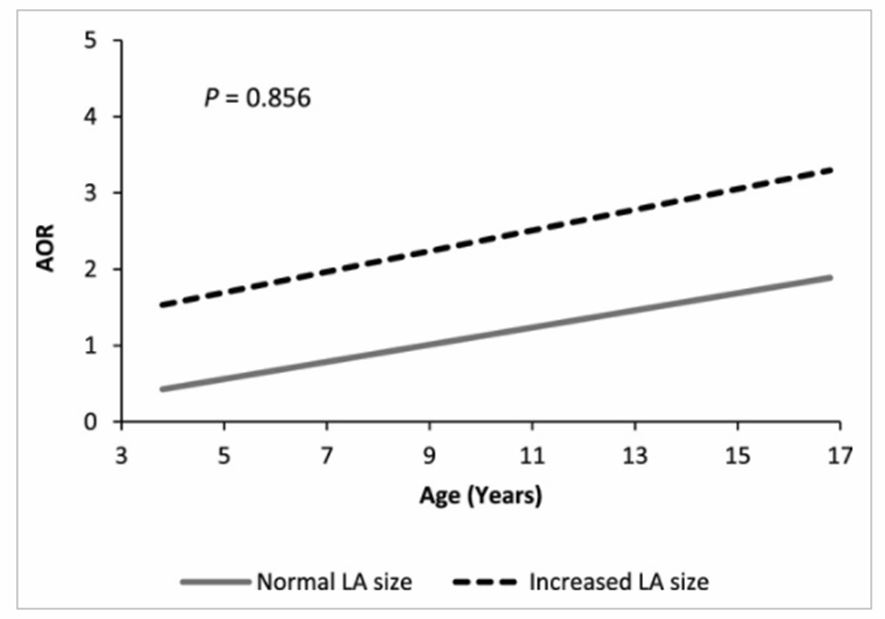
Рис. 2. Взаимодействие моделирует наличие или отсутствие увеличенного размера левого предсердия (LA) по возрасту как непрерывную переменную.
Обсуждение
В этом исследовании не было статистической связи между кашлем и ХСН, идентифицированными по радиологическим признакам кардиогенного отека легких, у собак с естественно приобретенной MMVD. Несколько наблюдений подтверждают этот вывод. Прежде всего, было ясно продемонстрировано, что стимуляция рецепторов кашля не происходит на альвеолярном или интерстициальном уровне, но только в проксимальных частях респираторного дерева (например, гортани, трахеи, бронхов) на разных животных моделях, включая собак [4]. Поэтому наличие жидкости в альвеолярных или интерстициальных пространствах не должно вызывать кашель у пациентов с отеком легких, если количество жидкости недостаточно для затопления верхних дыхательных путей. В таком случае ожидается, что жидкость произведет мягкий влажный кашель, сопровождаемый пеной мокротой, окрашенной кровью, как это наблюдается у людей [6]. Однако это явление обычно наблюдается только у собак с очень тяжелым или перкуторным кардиогенным отеком легких. Еще одно важное замечание, которое вытекает из нашего исследования, состоит в том, что собаки с отеком легких неизбежно проявляют одышку или тахипноэ, поддерживая тот факт, что изолированный кашель (без одышки или тахипноэ) является очень маловероятным признаком ХСН у собак. Это наблюдение было бы совместимо с наблюдениями у пациентов, у которых общие симптомы ХСН включают усталость, одышку, периферический отек и непереносимость физических упражнений, тогда как кашель считается лишь незначительным знаком [22]. Интересно, что недавнее исследование по оценке клинических и эхокардиографические переменные для определения наличия сердечной недостаточности у собак показали, что повышенная частота дыхания является одним из самых независимых предикторов ХСН у собак с дилатационной кардиомиопатией и MMVD [23].
Еще одно важное соображение заключается в том, что кашель является необычным нахождением у других домашних видов, пораженных CHF, таких как кошка или лошадь, тогда как тахипноэ или одышка представляют собой наиболее часто встречающиеся данные [11, 24]. Аналогичным образом, основной клинический вывод у собак, страдающих некардиогенным легочным отеком - тахипноэ или одышка, а не кашель [25, 26]. Наконец, недавние исследования прогностических характеристик у собак с ММВД не сообщают о кашле как существенной переменной, влияющей на выживаемость, что указывает на то, что кашель в отличие от респираторных усилий и непереносимости физических упражнений не является важным показателем тяжести ХСН у этих пациентов [27, 28]. Если кашель был сильным показателем CHF, выживаемость пациентов была бы затронута оценкой кашля в этих двух исследованиях.
Сопутствующее присутствие болезни дыхательных путей, предложенное аномальной рентгенографической картиной, представляет собой более высокий фактор риска кашля у собак с MMVD. Этот результат можно объяснить тем, что анатомическая локализация наблюдаемой основной патологии, как ожидается, будет связана с стимуляцией рецепторов кашля. Более того, сообщаемое соотношение шансов, возможно, было недооценено, учитывая отсутствие чувствительности стандартного рентгенографического исследования при выявлении динамического обвала дыхательных путей по сравнению с флюороскопией и бронхоскопией [16, 29]. Традиционная рентгенография также имеет слабую чувствительность к обнаружению инфекционного трахеобронхита («питомникового кашля», ), что является обычной причиной кашля у собак [10]. Подобным образом паразитарная инфекция Dirofilaria immitis или Oslerus osleri может вызвать кашель, не обязательно демонстрируя клинически значимые рентгенологические изменения. Неопластические поражения не наблюдались в отдельных случаях этого исследования, но они могут представлять собой еще один дифференциальный диагноз у более старых собак, пораженных MMVD. Сообщалось также о сосуществующих заболеваниях у людей, у которых сопутствующие заболевания, такие как хроническая обструктивная болезнь легких, наблюдаются у многих пациентов с ХСН [30].
Размер левого предсердия представляет собой другой потенциально важный кофактор для присутствия кашля у собак, пораженных MMVD, и это подтверждается повышенным риском у собак с увеличенным размером LA, наблюдаемым при торакальной рентгенографии или эхокардиографии. Это открытие подтверждает предыдущие наблюдения, что больший, чем обычно, сердечный размер может оказывать механическое дорзальное давление на дыхательные пути с последующей стимуляцией кашляющих рецепторов [18]. Однако такое давление не может быть основной причиной коллапса бронхов, как указано в исследовании, в котором связь между расширением ЛА и коллапсом дыхательных путей не была подтверждена у собак с ММВД [17].
Повышенный риск кашля у собак с рентгенографическим признаками заболевания дыхательных путей и увеличением размера ЛЖ также возникает из результатов многомерного анализа, предполагая, что эти 2 переменные являются наиболее важными факторами заболеваемости, вызывающими кашель у собак с ММВД. Однако статистический анализ также предполагает, что оба этих основных эффекта являются статистически независимыми. Тем не менее, в предыдущих сообщениях о молодых собаках, страдающих врожденными аномалиями сердца, сопровождающихся существенной кардиомегалией, не упоминается кашель как подающая жалоба [31, 32]. Поскольку заболевание дыхательных путей чаще наблюдается у более старых собак, кардиомегалия может быть более вероятной причиной кашля у пациентов с уже существующей болезнью дыхательных путей, по сравнению с молодыми людьми со здоровой дыхательной системой. Однако эта гипотеза, по-видимому, статистически не подтверждается результатами анализа взаимодействия, представленного в этом исследовании.
Смещающим фактором для понимания механизмов кашля у собак с MMVD является положительный клинический ответ, наблюдаемый после введения фуросемида, так называемого «фуросемидного терапевтического исследования», часто выполняемого в малой практике на животных, чтобы определить, может ли быть кашель отек легких [11]. Однако фуросемид также может оказывать несколько противовоспалительных и противокашлевых эффектов, что может привести к удовлетворительному ингибированию кашля, независимо от возможного присутствия (или отсутствия) ХСН у пациента [33, 34]. Другой смещающий фактор в этом контексте - общий самоограничивающий характер инфекционного трахеобронхита, предполагая, что некоторые из воспринимаемых противокашлевых эффектов фактически не могут быть вызваны самим назначением фуросемида. Очевидно, что все вышеперечисленные гипотезы потребуют дополнительных исследований.
Основным ограничением этого исследования является его ретроспективный дизайн. Пациенты были замечены разными врачами в разных учреждениях, поэтому клиническая и эхокардиографическая оценка может варьироваться. Кроме того, тип кашля не характеризовался у этих пациентов, а также его частота и тяжесть. Хотя уровень покоя или сна, измеренный у себя дома, должен был бы добавить важную информацию, эти данные были недоступны для всех пациентов [23, 35].
Другим важным ограничением является тот факт, что некоторые пациенты, возможно, уже получили диуретическое лечение до их кардиологической оценки. Хотя мы пытались исключить всех пациентов, которые получали диуретики за 24 часа до направления, некоторые остаточные терапевтические эффекты не могут быть полностью исключены. Однако мы считаем, что если диуретическое лечение было достаточным для устранения радиографических признаков отека легких в этих случаях, ожидается, что клиническое проявление будет соответствующим образом изменено. Напротив, сохранение кашля после успешного диуретического лечения предложило бы альтернативную основную причину, а не отек легких. Конкретные исследования дыхательных путей, такие как флюороскопия или бронхоскопия, проводились только у небольшого числа пациентов. Поэтому наличие или отсутствие заболевания дыхательных путей оценивали только рентгенографически, с техническими ограничениями, описанными выше. Однако это также справедливо для обнаружения радиографических признаков ХСН, а это означает, что доля собак в этом исследовании может иметь умеренный необнаруженный ХСН, несмотря на то, что грудная рентгенография считается клиническим «золотым стандартом» [23]. Кроме того, было сообщено и другие исследования показали, что радиографическая диагностика ХСН у собак связана с относительно высокой вариабельностью наблюдателя [23, 36]. Наконец, только относительно небольшое число собак имели радиографические изменения, согласующиеся с ХСН, и это, возможно, повлияло на силу статистических результатов. В заключение, это исследование показывает, что кашель не связан с CHF, связанный с кардиогенным отеком легких у собак с естественно приобретенным MMVD, тогда как аномальные рентгенологические характеристики дыхательных путей и увеличенный размер левого предсердия показали значительную связь с кашлем у этих собак. Исследование также демонстрирует, что пациенты с рентгенографическими показаниями отека легких обычно имеют тахипное или одышку, что указывает на то, что кашель, в отсутствие одышки или тахипноэ, редко следует рассматривать как единственный клинический признак ХСН у собак.
Литература
- Mazzone SB. An overview of the sensory receptors regulating cough. Cough 2005;1:1–9.
- Chang AB. Cough, cough receptors, and asthma in children. Pediatr Pulmonol 1999;28:59–70.
- Widdicombe J, Fontana G. Cough: What's in a name? Eur Respir J 2006;28:10–15.
- Widdicombe JG. A brief overview of the mechanisms of cough. In: Chung KF, Widdicombe J, Boushey HA, eds. Cough: Causes, Mechanisms and Therapy. Oxford: Blackwell; 2003:17–23.
- Widdicombe J. Airway receptors. Respir Physiol 2001;125:3–15.
- Farzan S. Cough and sputum production. In: Walker HK, Hall WD, Hurst JW, eds. Clinical Methods: The History, Physical and Laboratory Examinations, 3rd ed. London: Butterworths; 1990:207–210.
- Hargreaves M, Ravi K, Kappagoda CT. Responses of slowly and rapidly adapting receptors in the airways of rabbits to changes in the Starling forces. J Physiol 1991;432:81–97.
- Autran de Morais H, Saretta Schwartz D. Pathophysiology of heart failure. In: Ettinger SJ, Feldman EC, eds. Textbook of Veterinary Internal Medicine: Diseases of the Dog and Cat, 6th ed. Oxford: Elsevier Saunders; 2005:914–940.
- Fox PR. The history. In: Fox PR, Sisson D, Moise NS, eds. Textbook of Canine and Feline Cardiology: Principles and Clinical Practice, 2nd ed. London: Saunders; 1999:41–45.
- Ford RB. Infectious tracheobronchitis. In: King LG, ed. Textbook of Respiratory Diseases in Dogs and Cats. Philadelphia: Saunders; 2004:364–372.
- Kittleson MD, Kienle RD. Small Animal Cardiovascular Medicine. London: Mosby; 1998:36–46.
- Gompf RE. The history and physical examination. In: Tilley LP, Smith FWK Jr, Oyama M, Sleeper MM, eds. Manual of Canine and Feline Cardiology, 4th ed. St. Louis, MO: Saunders Elsevier; 2008:2–23.
- Ware WA. Cough. In: Ware WA, ed. Cardiovascular Disease in Small Animal Medicine. London: Manson Pub./The Veterinary Press; 2007:101–105.
- Haggstrom J, Kvart C, Pedersen HD. Acquired valvular heart disease. In: Ettinger SJ, Feldman EC, eds. Textbook of Veterinary Internal Medicine: Diseases of the Dog and Cat, 6th ed. Oxford: Elsevier Saunders; 2005:1022–1039.
- Atkins C, Bonagura J, Ettinger S, et al. Guidelines for the diagnosis and treatment of canine chronic valvular heart disease. J Vet Intern Med 2009;23:1142–1150.
- Johnson LR, Pollard RE. Tracheal collapse and bronchomalacia in dogs: 58 cases (7/2001–1/2008). J Vet Intern Med 2010;24:298–305.
- Singh MK, Johnson LR, Kittleson MD, et al. Bronchomalacia in dogs with myxomatous mitral valve degeneration. J Vet Intern Med 2012;26:312–319.
- Guglielmini C, Diana A, Pietra M, et al. Use of the vertebral heart score in coughing dogs with chronic degenerative mitral valve disease. J Vet Med Sci 2009;71:9–13.
- Hansson K, Haggstrom J, Kvart C, et al. Left atrial to aortic root indices using two‐dimensional and M‐mode echocardiography in Cavalier King Charles Spaniels with and without left atrial enlargement. Vet Radiol Ultrasound 2002;43:568–575.
- Cornell CC, Kittleson MD, Della Torre P, et al. Allometric scaling of M‐mode cardiac measurements in normal adult dogs. J Vet Intern Med 2004;18:311–321.
- Buchanan JW, Bucheler J. Vertebral scale system to measure canine heart size in radiographs. J Am Vet Med Assoc 1995;206:194–199.
- Watson RD, Gibbs CR, Lip GY. ABC of heart failure. Clinical features and complications. BMJ2000;320:236–239.
- Schober KE, Hart TM, Stern JA, et al. Detection of congestive heart failure in dogs by Doppler echocardiography. J Vet Intern Med 2010;24:1358–1368.
- Rose RJ, Hodgson DR. Protocols for common presenting complaints. In: Rose RJ, Hodgson DR, eds. Manual of Equine Practice. Philadelphia, PA: WB Saunders Company; 2000:31–32.
- Egenvall A, Hansson K, Sateri H, et al. Pulmonary oedema in Swedish hunting dogs. J Small Anim Pract 2003;44:209–217.
- Drobatz KJ, Saunders HM, Pugh CR, et al. Noncardiogenic pulmonary edema in dogs and cats: 26 cases (1987–1993). J Am Vet Med Assoc 1995;206:1732–1736.
- Borgarelli M, Savarino P, Crosara S, et al. Survival characteristics and prognostic variables of dogs with mitral regurgitation attributable to myxomatous valve disease. J Vet Intern Med2008;22:120–128.
- Haggstrom J, Boswood A, O'Grady M, et al. Effect of pimobendan or benazepril hydrochloride on survival times in dogs with congestive heart failure caused by naturally occurring myxomatous mitral valve disease: The QUEST study. J Vet Intern Med 2008;22:1124–1135.
- Macready DM, Johnson LR, Pollard RE. Fluoroscopic and radiographic evaluation of tracheal collapse in dogs: 62 cases (2001–2006). J Am Vet Med Assoc 2007;230:1870–1876.
- Janssen DJ, Spruit MA, Uszko‐Lencer NH, et al. Symptoms, comorbidities, and health care in advanced chronic obstructive pulmonary disease or chronic heart failure. J Palliat Med2011;14:735–743.
- Nguyenba TP, Tobias AH. Minimally invasive per‐catheter patent ductus arteriosus occlusion in dogs using a prototype duct occluder. J Vet Intern Med 2008;22:129–134.
- Hildebrandt N, Schneider C, Schweigl T, et al. Long‐term follow‐up after transvenous single coil embolization of patent ductus arteriosus in dogs. J Vet Intern Med 2010;24:1400–1406.
- Prandota J. Furosemide: Progress in understanding its diuretic, anti‐inflammatory, and bronchodilating mechanism of action, and use in the treatment of respiratory tract diseases. Am J Ther 2002;9:317–328.
- Sudo T, Hayashi F, Nishino T. Responses of tracheobronchial receptors to inhaled furosemide in anesthetized rats. Am J Respir Crit Care Med 2000;162:971–975.
- Rishniw M, Ljungvall I, Porciello F, et al. Sleeping respiratory rates in apparently healthy adult dogs. Res Vet Sci 2012;93:965–969.
- Hansson K, Haggstrom J, Kvart C, et al. Reader performance in radiographic diagnosis of signs of mitral regurgitation in Cavalier King Charles Spaniels. J Small Anim Pract 2009;50(Suppl 1):44–53.
^Наверх









