Двойное слепое рандомизированное плацебо-контролируемое исследование пимобендана у собак с дилятационной кардиомиопатией
Абстракт
Было проведено двойное слепое рандомизированное плацебо-контролируемое исследование с целью изучения влияния на класс сердечной недостаточности и выживаемость пимобендана, перорального сенсибилизирующего кальций инактиватора, у собак с диляционной кардиомиопатией (DCM). Пимобендан (0,3-0,6 мг / кг массы тела / г) или плацебо вводили английским кокер-спаниелям (CSs, n = 10) и доберманам пинчерам (DPs: n = 10), которые имели ДКМ в дополнение к фоновой терапии фуросемидом, эналаприлом и дигоксином. Добавление пимобендана к стандартной тройной терапии было связано со значительным улучшением класса сердечной недостаточности, независимо от породы (P <.02, тест суммы рангов Манна-Уитни). В целом, 8 из 10 животных в группе, получавшие пимобендан, и 1 из 10 животных в группе плацебо улучшили состояние сердечной недостаточности, по крайней мере, изменили функциональный класс Нью-Йоркской ассоциации сердца после начальной стабилизации (P = 0,005, точный тест Фишера ). Пимобендан не оказывал существенного влияния на выживаемость в CS (P = 0,77, логарифмический тест), но DP, обработанные пимобенданом, имели значительно более длительное время выживания по сравнению с плацебо (P <0,02, логарифмический тест) со средней выживаемостью время 329 дней в группе пимобендана по сравнению с 50 днями в группе плацебо и отношение риска 3,4 (95% доверительный интервал 1,4-39,8). Пимобендан приводил к значительному улучшению класса сердечной недостаточности при добавлении к стандартной терапии в этой группе собак с ДКМ и, возможно, способствовал улучшению выживаемости у DP.
Литертура. Fuentes V.L., Corcoran B., French A., Schober K.E., Kleemann R., Justus C. A double-blind, randomized, placebo-controlled study of pimobendan in dogs with dilated cardiomyopathy // J Vet Intern Med. 2002 May-Jun;16(3):255-261.
Пимобендан представляет собой бензимидазол-пиридазиноновый инодилятор. Пимобендан вызывает венодиляцию и артериодиляцию путем ингибирования фосфодиэстеразы (PDE) III и имеет позитивные инотропные эффекты в результате ингибирования ФДЭ III (например, амринона и милринона) и из-за сенсибилизации эффекта кальция. Сенсибилизаторы кальция влияют на взаимодействие кальция с комплексом тропонина С, [3,4] и увеличивают протяженность сокращения для данной цитозольной концентрации кальция. Эффект увеличенной преднагрузки, благодаря чему увеличение прочности миофиламентов приводит к увеличению укорочения, может функционировать с помощью аналогичного механизма. Этот инотропный механизм имеет свои преимущества, поскольку затраты на миокардиальную энергию ниже, чем с положительными инотропными агентами, действующими через циклический аденозинмонофосфат (цАМФ) [6-9]. В обработанных оболочкой препаратах из миофибринов скорость активности аденозинтрифосфатазы на единицу силы не изменилась с добавлением пиемобендана, несмотря на увеличение активного напряжения. В исследованиях пациентов с людьми потребление кислорода миокарда фактически может быть уменьшено при введении пимобендана [11]. Пимобендан также оказывает неблагоприятное воздействие на релаксацию левого желудочка и конечные дистастолические соотношения давления и объема [12-15].Положительный инотропный эффект пимобендана у собак был продемонстрирован в ряде исследований [9,13,16-19], в том числе у собак с миокардиальной недостаточностью, где эффект традиционных положительных инотропных агентов часто затуплен. Кальций-сенсибилизирующий эффект пимобендана может преобладать над эффектом PDE III при хронической сердечной недостаточности, из-за которой регулирование пути передачи сигналов цАМФ происходит не только путем понижающей регуляции бета-адренергических рецепторов, но также путем увеличения ингибирующей субъединицы G-белкового комплекса и активации α-адренергической ресецептор-киназы, что уменьшает эффект введения ФДЭ III [22,23]. Вазодилатационные эффекты пимбендана возникают в результате ингибирования ПДЭ III и приводят к как венедиляции, так и артериодификации [18,24,25]. Исследования у собак после в/в введения и при сердечной недостаточности человека пациенты после введения п/о, демонстрируют снижение давления наполнения и системно-сосудистой резистентности [13,14,18,26-31]. Исследования пимобендана при ппатологии сердца у человека с ХСН продемонстрировали улучшение толерантности к физической нагрузке и превышение потребления кислорода [26,27,32-35], в отличие от постоянного влияния ингибиторов ФДЭ на физическую активность [36,37]. Большинство исследований также показали улучшение качества жизни [32,33]. Результаты были благоприятными в гуманистических исследованиях, сравнивающих лечение ингибиторами фермента пименбендана и ангиотензин-конвертирующего фермента (ACE) [26,34,39] и дополнительные преимущества были обнаружены при добавлении пимобендана к фоновой терапии диуретиков, ингибиторов АПФ, дигоксина и карведилола [40]. Это двойное слепое плацебо-контролируемое исследование было предпринято для изучения эффектов пимобендана у собак с дилатационной кардиомиопатией (DCM). Обстоятельства в клиническом течении диляционной кардиомиопатии у собак были отмечены среди пораженных пород, интерпретация любой лекарственной терапии с ответными реакциями является сложной, когда несколько пород встречаются. Для этого исследования были привлечены две конкретные породы: доберманские пинчеры (DP) и английские кокер-спаниели (CS), отражающие 2 породы с контрастирующим клиническим течением. У пациентов с очень низким прогнозом очень низкий прогноз, при этом большинство доз менее 6 месяцев после постановки диагноза [42,43].
Таблица 1. Система оценки сердца Нью-Йорка (NYHA), используемая для оценки функциональной тяжести сердечной недостаточности
| NYHA функциональный класс | Клинические признаки |
| 1 | Наличие сердечной болезни, но отсутствие клинических симптомов или незначительная непереносимость физических упражнений (при значительных нагрузках) |
| 2 | Наличие сердечной болезни, но нет клинических симптомов, кроме снижения выносливости при выполнении физических упражнений. Умеренная активность вызывает усталость, одышку или и то, и другое. |
| 3 | Сердечная болезнь связана с клиническими признаками, например, кашлем или одышкой, но отсутствием симптомов в покое |
| 4 | Кардиальная болезнь, связанная с тяжелой сердечной недостаточностью, такая, что животное проявляет клинические признаки в состоянии покоя или невозможностью выполнять какие-либо физические нагрузки |
Прогноз лучше у CS, а некоторые собаки выживают в течение более 4 лет после постановки диагноза [44,45].
Целью этого клинического испытания было оценить эффективность и влияние пимобендана на долгосрочную выживаемость у собак с DCM при использовании в сочетании с фоновой терапией фуросемидом, эналаприл и дигоксином.
Материалы и методы
Исследование соответствовало Закону 1986 года об использовании животных (для научных процедур) и информационное согласие было получено от каждого владельца. Субъекты доберманы (n = 10) и CS (n= 10), представленные с застойной сердечной недостаточностью от диляционной кардиомиопатией в клинику мелких животных, Королевской школы ветеринарных исследований, были завербованы для исследования. Все собаки в настоящее время модифицированы в Нью-Йоркской ассоциации сердца (NYHA) класса 3 или 4 (таблица 1) или были в модифицированном классе NYHA 3 или 4 за две недели до презентации.
Критерии включения включали эхокардиографическое подтверждение расширенного, гипоконтрактильного левого желудочка в отсутствие выраженного клапанного заболевания или врожденных пороков сердца, а также рентгенологические данные о отеке легких. У 3 из CS было отмечено субъективное утолщение листочков митрального клапана, но у всех был увеличенный индекс конечного систолического объема левого желудочка, согласующийся с миокардиальной недостаточностью [46,47]. Гендерное распределение в группах пимобендана и плацебо было сходным, с 1 стерилизованной самкой в обеих группах CS и 2 стерилизованных самца и 3 мужчины (или кастрированные самцы) в каждой группе DP. Медиана возраста составляла 6 лет (3-9 лет) в группе плацебо CS и 9 лет (3-14 лет) в группе, получавшей пимобендан. Средний возраст составлял 10 лет (8-10 лет) в группе плацебо DP и 9 лет (6-9 лет) в обработанных пимобенданом DP. В начале терапии все КС были в синусисовом ритме, а 1 DP в группе пимобендана находились в состоянии фибрилляции предсердий, по сравнению с 3 плацебо-обработанными ДП. Медиана класса NYHA был 3.0 (3.0-4.0) в группе плацебо и 3.5 (2.0-4.0) в группе пимобендана.
Параллельная терапия
Первичная терапия с использованием диуретиков или ингибиторов АПФ не была исключением. При входе в исследование все собаки были обработаны ПО фуросемидом, эналаприлом, а также дигоксином, при использовании любых дополнительных лекарств были выведены в течение по меньшей мере 10 дней. Было дано действие фуросемида (2-9 мг / кг / день РО в разделенных дозах), эналаприл назначался при 0,5 мг / кг PO q12-24h, а концентрация дигоксина в сыворотке была подтверждена в терапевтическом диапазоне 0,6- 1,9 нг / мл до начала исследования лекарственного препарата. Средние дозы фуросемида, эналаприла и дигоксина не были значительно различными для собак, получавших плацебо против пимобендана (таблица 2). DP и CS были рандомизированы отдельно для приема либо пимобендана (0,3-0,6 мг / кг / сут PO), либо плацебо в дополнение к стандартной тройной терапии, согласно двойному слепому протоколу. Рандомизация проводилась за пределами участка по 10 для каждой породы с помощью запатентованного программного обеспечения, с наличием капсул (независимо от того, поддерживает ли пимобендан или плацебо).
Ни одна собака не получала никаких пероральных препаратов в течение периода исследования от фуросемида, эналаприла, дигоксина и пимобендана. Одна группа CS в группе плацебо периодически вводила актуальные препараты для терапии болезни уха в течение всего периода исследования.
Дизайн исследования
Клиническое состояние каждого испытуемого оценивали с базовым и трехнедельным интервалом для ДП и с интервалом в 6 недель для КС. Помимо информации об ответе пациента, предоставленный владельцем, полный физический осмотр, ЭКГ в 6 отведении, грудная радиография и эхокардиограмма были получены при каждой переоценке. Основными переменными исследования были модифицированные классы NYHA и время выживания.
Время выживания рассчитывалось как период от начала лечения пимобенданом или плацебо до смерти животного, снятия исследования или окончания 4-летнего периода исследования (в зависимости от того, что было самым распространенным).
Вывод из исследования был оценен как смертельный случай, хотя время выживания, возможно, было более продолжительным.
Некардиальными причинами депрессии и эвтаназии для трудноизлечимой сердечной недостаточности также были обработаны данные.
Результаты статистического анализа представлены как среднее стандартное отклонение (SD), 95% доверительные интервалы среднего (95% ДИ) или медианное значение andrange. Точный критерий Фишера был использован для оценки ответа на пимобендан или плацебо в виде двоичных данных (улучшенных / не улучшенных) после введения лечения традиционной терапии. Улучшение было отмечено путем достижения более низкого модифицированного класса NYHA в любой момент периода исследования в отношении класса NYHA, достигнутого после стабилизации при традиционной терапии. Для сравнения выживаемости кривые Каплана-Мейера были сконструированы, и для оценки кривых выживаемости использовались логарифмические тесты с коэффициентом риска, выраженным как 95% ДИ. Уровень значимости был установлен на 0,05. Все статистические данные выполнялись с использованием проприетарных статистических программных программ.
Результаты исследования
Клиническая эффективность терапии
После начала стандартной тройной терапии обе группы улучшались до среднего класса NYHA 2.0 (диапазон в плацебо группа, 2,0-4,0; диапазон в группе пимобендана, 2,0-3,0; рисунок 1).
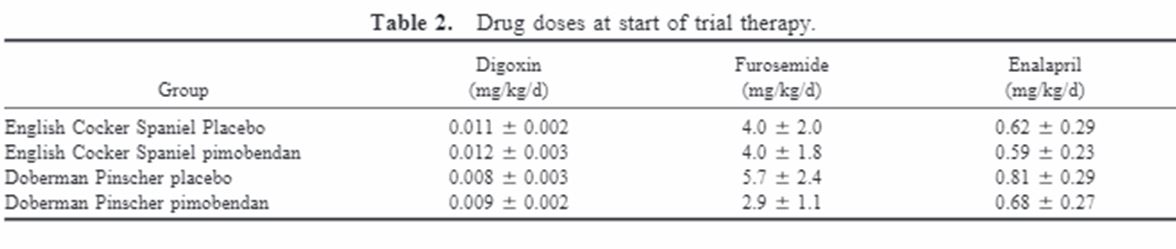
Медиана значений для самого низкого класса NYHA, достигнутого в любой точке за период исследования, составляло 2,0 (1,0-4,0) для группы плацебо и 1,0 (1,0-2,0) для группы, обработанной пимобенданом. Не было обнаружено статистической разницы между группами плацебо и пимобендана для класса NYHA при первоначальном представлении или после традиционной терапии, но суммарный тест Mann-Whitney показал значительное улучшение в ФК ХСН во время лечения с помощью пимобендана по сравнению с плацебо (P менее 0,02). Только 1 из 10 собак, получавших плацебо, продемонстрировали дальнейшее улучшение после стабилизации с обычной терапией, тогда как 8 из 10 собак, принимавших пимобендан, в течение периода исследования (P менее 0,005, точное исследование Фишера) показали дальнейшее улучшение. Две собаки развили сахарный диабет в ходе исследования: CS в группе плацебо и DP в группе пимобендана. У одной CS в группе плацебо было 2 эпизода засвидетельствованного синкопе. Сурваривация. При тяжелой ХСН CS умерли в течение последующего периода. Три из этих животных были подвергнуты эвтаназии для некардиальных заболеваний. Одна собака в группе плацебо была подвергнута эвтаназии с желудочно-кишечным заболеванием, а 2 собаки были подвергнуты эвтаназии в группе пимобендана (1 с носовой опухолью и 1 с нечистоплотностью - недержание кала). Одно животное в группе пимобендана внезапно умерло в течение 1 месяца после постановки диагноза.
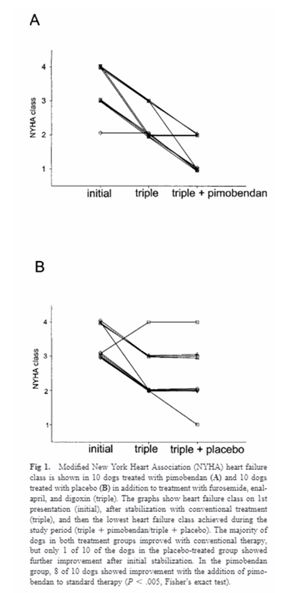
Все остальные CS были оживленными в конце периода исследования, хотя 1 группа из группы плацебо была отозвана из исследования, проведенного с сахарным диабетом. Средняя выживаемость в соответствии с анализом Каплана-Мейера (включая смертность от всех причин и исследование) составила 537 дней (диапазон 61-1428 дня) в группе замедленного периода и 1037 дней (диапазон 51-1127 дней) в группе пимобендана (P менее 0.77 , Рис. 2А). DP. Все доберманы погибли в течение периода исследования. Шесть собак умерли внезапно (по 3 собаки в каждой группе), а 2 собаки были эвтаназированы с трудноизлечимой сердечной недостаточностью (группа плацебо). Одна собака в группе пимобендана развила иммуно-опосредованную гемолитическую анемию, которую лечили кортикостероидами, а затем развивался панкреатит. Признаки застойной неудачи повторялись с помощью флюоротерапии и ее смерть не была замечена, так что не было ясно, какое из условий в первую очередь несет ответственность за ее смерть. Обработанный пимобенданом DP, у которого развивался сахарный диабет, был отозван из исследования через 329 дней.
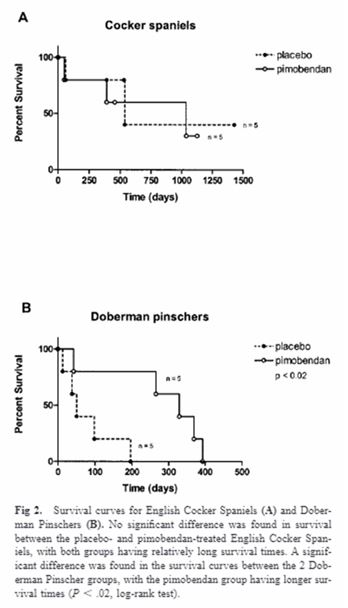
Лечение пимобенданом прекратилось, хотя он продолжил стандартную терапию и был подвергнут эвтаназии для застойной недостаточности в течение 2 месяца. Анализ логарифмического ранжирования, сравнивающий кривые выживаемости, показал существенные различия между DP-плацебо и пимобенданом (P менее 0,02; рис. 2B). Медиана времени выживания для DP, обработанных пимобенданом, составляло 329 дней (диапазон 42-393 дня), а медиана время выживания в группе плацебо составляло 50 дней (диапазон 13-196 дней), с опасностью лечения 3,4 (95% ДИ 1.4 -39.8).
Обсуждение полученных результатов
В этом исследовании изучалось влияние пимобендана на собак с DCM при добавлении к фоновой терапии фуросемидом, эналаприлом и дигоксином. В обеих породах добавление пимобендана к стандартному протоколу лечения было связано с существенным улучшением функционального класса сердечной недостаточности. В целом, 8 из 10 животных в группе, получавшей пимобендан, улучшили свой модифицированный статус класса NYHA в течение периода исследования, по сравнению с 1 из 10 животных в группе плацебо. Таким образом, терапия пимобенданом, по-видимому, приносила дополнительные преимущества по сравнению с фоновой терапией: диуретиком, эналаприлом и дигоксином. Хотя возраст в 2 группы DP были схожими, незначительная тенденция к более раннему возрасту была обнаружена в группе CS-плацебо по сравнению с группой CS пимобендана. Более ранний возраст диагноза ассоциировался с более низким прогнозом ДКМ и, возможно, был фактором более низкого ответа в группе плацебо CS по сравнению с группой CS пимобендана [48]. В конце 4-летнего периода исследования 6 из 10 CS были эвтаназированы и 3 из 10 CS умерли от некардиологической болезни, тем самым подтвердив предыдущие наблюдения, что у CS с диляционной кардиомиопатией есть потенциал для длительного времени выживания. Отсутствие очевидной пользы от времени выживания не исключает возможности потенциального неблагоприятного воздействия пимобендана в КС, хотя исследование не обладало достаточной способностью к подобной возможности. Из результатов этого исследования любое испытание, не влияющее на терапию на выживаемость CS с диляционной кардиомиопатией, очевидно, должно было бы иметь гораздо более длительную продолжительность и включать большее количество собак. Хотя было проверено, что время выживания может быть выше среднего в группе СКС по сравнению с историческим контролем, величина времени выживания и частоты некардиальной смерти не ожидалось. Несмотря на то, что известно, что у людей с низким уровнем выживаемости после развития застойных признаков было обнаружено значительное увеличение выживаемости у пациентов, получавших пимобендан, с медианной выживаемостью 50 дней в группе плацебо по сравнению с 329 днями в группе пимобендана (P менее 0,02, логарифмический ранг). Это находка контрастирует с преобладающим отношением к использованию положительных инотропных агентов при лечении хронической сердечной недостаточности у пациентов, где ряд проб продемонстрировали негативное влияние на выживаемость, несмотря на краткосрочные преимущества гемодинамики [37,50-52].
Каким образом, когда кратковременное качество жизни заметно улучшается, любое увеличение смертности считается неприемлемым при лечении сердечной недостаточности человека [52,53]. Однако соответствующее использование положительных инотропных агентов у пациентов с людьми является полем спора, особенно потому, что различия могут возникать вне зависимости от дозы, и является ли лечение кратковременным, прерывистым или долгосрочным [54-57]. Причина увеличения смертности с долгосрочным использованием некоторых положительных инотропов у пациентов с человеческим здоровьем неизвестна, но может связаны с увеличением концентрации цитозольного кальция, поскольку повышенные концентрации кальция предрасполагают к аритмии и могут увеличить вероятность внезапной смерти. Дополнительные проблемы, связанные с положительными инотропами, включают увеличение затрат энергии на миокард, хотя это менее значимо для PDE-ингибиторов, где артериодикационные эффекты могут приводить к сокращению нагрузки на клетки в достаточной степени, чтобы компенсировать увеличение потребления энергии из-за повышенной сократимости [58]. Было показано, что пимобендан увеличивает выживаемость кардиомиопатических сирийских хомяков. У людей исследования показали сокращение числа госпитализаций или противников с помощью пимобендана по сравнению с плацебо, [31,32,60] хотя не было опубликовано исследований пациентов с сердечной недостаточностью у людей, где выживаемость была первичной конечной точкой. Использовали 24-часовой мониторинг Холтера, чтобы продемонстрировать какие-либо проаритмические тенденции [31,34,60]. Пимобендан при застойной сердечной недостаточности (PICO), в течение 317 пациентов, прошедших более 6 месяцев, не был разработан как исследование выживаемости, но показал незначительную тенденцию к увеличению смертности в группе с низкой дозой пациентов, получавших пимобендан [35]. Однако число смертей в группе с высокой дозой пимобендана в исследовании PICO было идентичным количеству плацебо-группы. В недавнем исследовании пациенты с неишемической диляционной кардиомиопатией, которые не могли переносить бета-адренергические антагонисты, пимобендана не оказывал вредного воздействия на выживание в течение 2 лет, когда его добавляли к стандартной терапии. В этом человеческом исследовании у пациентов, получавших пимобендан в дополнение к стандартной терапии, были более низкие требования к дополнительным лекарственным средствам для ухудшения сердечной недостаточности, по сравнению с пациентами, получавшими стандартную терапию и плацебо [60]. Отличия могут возникать при исходе пациентов с ишемическим и неишемическим или с более благоприятным ответом к пимобендану [35,60]. Тем не менее, в отсутствие каких-либо специально разработанных испытаний выживания, влияет ли эффект смертности от пимобендана у пациентов с сердечной недостаточностью у человека от других положительных инотропных агентов. Добавление пимобендана к традиционной терапии у DPs в нашем исследовании привело к выживанию, хотя истинную величину эффекта трудно оценить с помощью неравномерного числа собак с фибрилляцией предсердий в 2 группах.
Влияние на выживание в КС было неясным, потому что их время выживания в целом было таким большим. Возможность неоспоримого эффекта внезапной смерти КС в группе пимобендана не может быть исключена, хотя было обнаружено, что не было обнаружено повышение скорости внезапной смерти в ДП. Эффект положительных инотропных агентов на выживание при собачьей сердечной недостаточности не был критически оценен и достоверность экстраполяции из испытаний на людях остается неизвестной. Несмотря на зловещие долгосрочные эффекты у пациентов с сердечной недостаточностью у пациентов с ишемической болезнью, клинические испытания милринона оказались очень перспективными в лечении сердечной недостаточности у собак [61-64], хотя исследования никогда не распространялись на долгосрочные плацебоконтактные испытания, которые могут неблагоприятно влиять на выживаемость в группе плацебо DP, способствуя различиям в выживаемости. Группа плацебо DP включала в себя большее число собак с фибрилляцией предсердий (3 из 5 собак против 1 из 5 собак в группе пимобендана). Показано, что афильная фибрилляция связана с периодами плохого выживания у доберманов с диляционной кардиомиопатией, с медианой выживаемости всего лишь 2,9 недель в 1 исследовании [43]. Ввиду этого было бы предпочтительнее иметь отдельное рандомизированное расписание для собак с фибрилляцией предсердий, поскольку ожидается, что супрессивное время будет короче. Случайное исследование, к сожалению, привело к неравномерному распределению случаев фибрилляции предсердий, что, возможно, оказало неоправданное влияние на результат. Это может отразиться на более высокой дозе фуросемида в группе плацебо.
Однако выборка была слишком мала, чтобы обеспечить субанализ DP без случаев фибрилляции предсердий. Тем не менее, собака с атриальной фибрилляцией в группе пимобендана выжила в течение 265 дней, несмотря на наличие асцита и плеврального выпота при первоначальном осмотре. Комбинация фибрилляции предсердий и прерывистое сердцебиение была связана с особенно плохим прогностическим признаком в исследовании Calvert et al. [43] с такими собаками, имеющими среднее время жизни всего 2.0 недели и диапазон 1-13 недель, но это DP выжил в течение 37 недель. Только 1 DP с фибрилляцией предсердий в группе пимобендана, зная, является ли это случайным эффектом или связано с лечением пимобендана, сложно. Один из обработанных пимобенданом ДП впоследствии развил фибрилляцию предсердий после изъятия из исследования (и, таким образом, был удален из лечения пимобенданом, хотя и продолжал стандартное лечение), и 1 из плацебо-обработанных КС развили аритмическую фибрилляцию во время курса лечения. Хотя некоторые из преимуществ видели в обработанном пимобенданом DP, скорее всего, было связано с устойчивым улучшением в гемодинамической функции, другие факторы, которые также играют определенную роль. Улучшая гемодинамическую функцию, пимобендан может приводить к косвенной редукции нейрогормональной активации. Несколько исследований показали индукцию в нейрогормональной активации с уменьшением уровней норадреналина в плазме [28,60] , атриальных и мозговых натрийуретических гормонов 60 [ ] и уровней эндотелина-1 [40]. Кроме того, эффекты являются побочными эффектами на провоспалительные цитокины, при этом редукции снижаются при факторах некроза опухоли альфа и интерлейкин (IL) -1b [65] и IL-6 [40]. Когда все эвтаназированные животные не подвергаются цензурированию в исследовании на выживаемость, влияние сроков эвтаназии должно быть учтено. Два из плацебо-обработанных ДП были эутанизированы по просьбе владельцев после развития застойной сердечной недостаточности, что не отвечало на увеличение дозы диуретиков. У двух из собак, получавших пимобендан, также развилась застойная сердечная недостаточность в течение периода исследования, но это было после развития анемии и панкреатита у 1 собаки, а после отмены пимобендана после развития сахарного диабета в другом.
Время выживания собаки затем оценивалось до момента отклонения от исследования, хотя он выжил еще 2 месяца при стандартной тройной терапии без пимобендана перед развитием рецидива застойных признаков. В обеих случаях развитие застойной сердечной недостаточности было более чем через 350 дней после входа в исследование. Не было сделано попыток зарегистрировать 24-часовой амбулаторный запись ЭКГ или стратифицировать риск смертельной аритмии. В каждой группе лечения DP наблюдались три смертельных случая, и в группе, получавшей пимобендан, была отмечена смерть, все из которых считались кардиологическими [66,67]. Хотя в этом исследовании не было очевидным влияние на выживаемость, амбулаторные ЭКГ-записи были бы важны для идентификации риска проаритмии, связанной с пимобенданом и ее следует рассматривать в более широком исследовании. В ходе исследования не было стандартизировано, хотя было показано, что применение таурина и карнитина может быть полезным у Американских кокер-спаниелей с низкими концентрациями таурина в крови при DCM [68]. Сыворотка или цельная крови не были измерены ни у одной из собак в этом исследовании, хотя авторы ранее не смогли идентифицировать низкие концентрации таурина в сыворотке в любых кокер-спаниелей с диляционной кардиомиопатией (неопубликованные наблюдательные наблюдения). На это исследование обычно не регистрировали давление в крови, хотя гипотензия представляет собой потенциальный риск с тяжелой ДКМ у доберманов, использование ингибиторов АПФ и с вазодилатирующими эффектами пимобендана. Гипотония, если она присутствует, не принесла клинических признаков. Хотя размер выборки в этом исследовании был небольшим, результаты показывают, что пимобендан может быть полезной для собак с застойной сердечной недостаточностью, связанной с DCM. Пимобендан приводил к улучшению функционального класса при ХСН и был связан с уменьшением симптомов и смертности у пациентов с сердечной недостаточностью, имевших застойную сердечную недостаточность в этом исследовании. Эти результаты показывают, что проведение более тщательного исследования с более длительной продолжительностью наблюдения было бы целесообразным, чтобы оценить эффект пимобендана в широком диапазоне собак с диляционной кардиомиопатией.
Литература
- Adams KF Pathophysiologic role of the renin‐angiotensin‐aldosterone and sympathetic nervous systems in heart failure. Am J Health Syst Pharm2004;61(Suppl):S4–S13.
- Colucci WS. The effects of norepinephrine on myocardial biology: Implications for the therapy of heart failure. Clin Cardiol 1998;21:I20–I24.
- Laks MM, Morady F., Swan HJ.Myocardial hypertrophy produced by chronic infusion of subhypertensive doses of norepinephrine in the dog. Chest1973;64:75–78.
- Packer M., Coats AJ, Fowler MB, et al.Effect of carvedilol on survival in severe chronic heart failure. N Engl J Med2001;344:1651–1658.
- Krum H., Sackner‐Bernstein JD,Goldsmith RL, et al. Double‐blind, placebo‐controlled study of the long‐term efficacy of carvedilol in patients with severe chronic heart failure. Circulation1995;92:1499–1506.
- Lowes BD, Gill EA, Abraham WT, et al.Effects of carvedilol on left ventricular mass, chamber geometry, and mitral regurgitation in chronic heart failure. Am J Cardiol 1999;83:1201–1205.
- Sisson DD. Neuroendocrine evaluation of cardiac disease. Vet Clin North Am Small Anim Pract 2004;34:1105–1126.
- Rush JE, Freeman LM, Hiler C., et al.Use of metoprolol in dogs with acquired cardiac disease. J Vet Cardiol 2002;4:23–28.
- Tidholm A. Beta‐blocker use in canine DCM. Proceedings of the 24th Annual Form of the American College of Veterinary Internal Medicine. Louisville, KY, 2006.
- Amberger CN. Effect of carvedilol on ventricular function, symptoms, and survival time in 25 dogs with heart failure ISACHC class III Proceedings of the European College of Veterinary Internal Medicine: Neuchatel, Switzerland, September 2000.
- Xue SR, Xue Y., Xue R. Carvedilol restore cardiac calcium release channel structure and function in heart failure. Int J Cardiol 2007; 116:231–235.
- Zhang S., Sun Z., Liu L., et al.Carvedilol attenuates CPB‐induced apoptosis in dog heart: Regulation of Fas/FasL and caspase‐3 pathway. Chin Med J (Engl) 2003;116:761–766.
- Hamburger SA, Barone FC,Feuerstein GZ, et al. Carvedilol (Kredex) reduces infarct size in a canine model of acute myocardial infarction.Pharmacology 1991;43:113–120.
- Nikolaidis LA, Poornima I., Parikh P., et al. The effects of combined versus selective adrenergic blockade on left ventricular and systemic hemodynamics, myocardial substrate preference, and regional perfusion in conscious dogs with dilated cardiomyopathy. J Am Coll Cardiol2006;47:1871–1881.
- Oyama MA, Sisson DD, Solter PF.Prospective screening for occult cardiomyopathy in dogs by measurement of plasma atrial natriuretic peptide, B‐type natriuretic peptide, and cardiac troponin‐I concentrations. Am J Vet Res2007;68:42–47.
- Sahn DJ, DeMaria A., Kisslo J., et al.Recommendations regarding quantitation in M‐mode echocardiography: Results of a survey of echocardiographic measurements.Circulation 1978;58:1072–1083.
- Thomas WP, Gaber CE, Jacobs GJ, et al. Recommendations for standards in transthoracic two‐dimensional echocardiography in the dog and cat. Echocardiography Committee of the Specialty of Cardiology, American College of Veterinary Internal Medicine. J Vet Intern Med 1993: 7: 247–252.
- Buchanan JW, Bucheler J. Vertebral scale system to measure canine heart size in radiographs. J Am Vet Med Assoc1995;206:194–199.
- The IMPROVE Study Group Acute and short‐term hemodynamic, echocardiographic, and clinical effects of enalapril maleate in dogs with naturally acquired heart failure: Results of the Invasive Multicenter PROspective Veterinary Evaluation of Enalapril study. J Vet Intern Med 1995;9:234–242.
- Di Lenarda A., Sabbadini G.,Salvatore L., et al. Long‐term effects of carvedilol in idiopathic dilated cardiomyopathy with persistent left ventricular dysfunction despite chronic metoprolol. The Heart‐Muscle Disease Study Group. J Am Coll Cardiol 1999: 33: 1926–1934.
- Gerson MC, Craft LL, McGuire N., et al. Carvedilol improves left ventricular function in heart failure patients with idiopathic dilated cardiomyopathy and a wide range of sympathetic nervous system function as measured by iodine 123 metaiodobenzylguanidine. J Nucl Cardiol 2002;9:608–615.
- Hirooka K., Yasumura Y., Ishida Y., et al. Comparative left ventricular functional and neurohumoral effects of chronic treatment with carvedilol versus metoprolol in patients with dilated cardiomyopathy. Jpn Circ J 2001;65:931–936.
- Packer M., Bristow MR, Cohn JN, et al. The effect of carvedilol on morbidity and mortality in patients with chronic heart failure. N Engl J Med 1996;334:1349–1355.
- Packer M., Colucci WS, Sackner‐Bernstein JD, et al. Double‐blind, placebo‐controlled study of the effects of carvedilol in patients with moderate to severe heart failure. The PRECISE Trial. Prospective Randomized Evaluation of Carvedilol on Symptoms and Exercise.Circulation 1996: 94: 2793–2799.
- Asanuma H., Minamino T., Sanada S., et al. Beta‐adrenoceptor blocker carvedilol provides cardioprotection via an adenosine‐dependent mechanism in ischemic canine hearts. Circulation2004;109:2773–2779.
- Feuerstein GZ, Yue TL, Cheng HY, et al. Myocardial protection by the novel vasodilating beta‐blocker, carvedilol: Potential relevance of anti‐oxidant activity. J Hypertens Suppl 1993;11:S41–S48.
- Kaye DM, Johnston L., Vaddadi G., et al. Mechanisms of carvedilol action in human congestive heart failure.Hypertension 2001;37:1216–1221.
- Franciosa JA, Nelson JJ, Lukas MA, et al. Heart failure in community practice: Relationship to age and sex in a beta‐blocker registry. Congest Heart Fail2006;12:317–323.
- Ho WJ, Tsay PK, Chu PH, et al.Predictors of stable outcome in treating chronic heart failure patients with carvedilol. Jpn Heart J 2004;45:823–832.
- Calvert CA, Hall G., Jacobs G., et al.Clinical and pathologic findings in Doberman Pinschers with occult cardiomyopathy that died suddenly or developed congestive heart failure: 54 cases (1984–1991). J Am Vet Med Assoc1997;210:505–511.
- Sandusky GEJ, Capen CC, Kerr KM.Histological and ultrastructural evaluation of cardiac lesions in idiopathic cardiomyopathy in dogs. Can J Comp Med1984;48:81–86.
- Oyama MA, Chittur S. Genomic expression patterns of cardiac tissues from dogs with dilated cardiomyopathy.Am J Vet Res 2005;66:1140–1155.
- Lopes R., Solter PF, Sisson DD, et al.Characterization of canine mitochondrial protein expression in natural and induced forms of idiopathic dilated cardiomyopathy. Am J Vet Res2006;67:963–970.
- Lopes R., Solter PF, Sisson DD, et al.Correlation of mitochondrial protein expression in complexes I to V with natural and induced forms of canine idiopathic dilated cardiomyopathy. Am J Vet Res 2006;67:971–977.
- Hall SA, Cigarroa CG, Marcoux L., et al. Time course of improvement in left ventricular function, mass and geometry in patients with congestive heart failure treated with beta‐adrenergic blockade. J Am Coll Cardiol 1995;25:1154–1161.
- Hunt SA, Baker DW, Chin MH, et al.ACC/AHA guidelines for the evaluation and management of chronic heart failure in the adult: Executive summary. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee to revise the 1995 Guidelines for the Evaluation and Management of Heart Failure). J Am Coll Cardiol 2001: 38: 2101–2113.
- McMurray J., Cohen‐Solal A., Dietz R., et al. Practical recommendations for the use of ACE inhibitors, beta‐blockers, aldosterone antagonists and angiotensin receptor blockers in heart failure: Putting guidelines into practice. Eur J Heart Fail2005;7:710–721.
- Konstam MA. Progress in heart failure management? Lessons from the real world. Circulation 2000;102:1076–1078.
- Abbott JA, Broadstone RV, Ward DL, et al. Hemodynamic effects of orally administered carvedilol in healthy conscious dogs. Am J Vet Res 2005;66:637–641.
- Gordon SG, Arsenault WG,Longnecker M., et al. Pharmacodynamics of carvedilol in conscious, healthy dogs. J Vet Intern Med 2006;20:297–304.
- Arsenault WG, Boothe DM, Gordon SG, et al. Pharmacokinetics of carvedilol after intravenous and oral administration in conscious healthy dogs. Am J Vet Res2005;66:2172–2176.
- Uechi M., Sasaki T., Ueno K., et al.Cardiovascular and renal effects of carvedilol in dogs with heart failure. J Vet Med Sci 2002;64:469–475.
- Tsutamoto T., Wada A., Maeda K., et al. Attenuation of compensation of endogenous cardiac natriuretic peptide system in chronic heart failure: Prognostic role of plasma brain natriuretic peptide concentration in patients with chronic symptomatic left ventricular dysfunction. Circulation1997;96:509–516.
- Bettencourt P., Frioes F., Azevedo A., et al. Prognostic information provided by serial measurements of brain natriuretic peptide in heart failure. Int J Cardiol2004;93:45–48.
- Latini R., Masson S., Anand I., et al.The comparative prognostic value of plasma neurohormones at baseline in patients with heart failure enrolled in Val‐HeFT. Eur Heart J 2004;25:292–299.
- Berger R., Huelsmann M., Strecker K., et al. Neurohormonal risk stratification for sudden death and death owing to progressive heart failure in chronic heart failure. Eur J Clin Invest 2005;35:24–31.
- Richards AM, Doughty R., Nicholls MG, et al. Neurohumoral prediction of benefit from carvedilol in ischemic left ventricular dysfunction. Australia‐New Zealand Heart Failure Group. Circulation1999: 99: 786–792.
- Hartmann F., Packer M., Coats AJ, et al. Prognostic impact of plasma N‐terminal pro‐brain natriuretic peptide in severe chronic congestive heart failure: A substudy of the Carvedilol Prospective Randomized Cumulative Survival (COPERNICUS) trial. Circulation2004;110:1780–1786.
^Наверх









