Распространенность и прогноз развития анемии у собак с дегенеративным митральным клапанным заболеванием

Yu I.B., Huang H.P. Prevalence and Prognosis of Anemia in Dogs with Degenerative Mitral Valve Disease // Biomed Res Int. 2016;2016:4727054.
Информация об авторах: Ю И.Б., Хуанг Х.П.
Аннотация
У людей сердечная недостаточность (ХСН) и почечная недостаточность (ХПН) имеют отрицательные эффекты на прогноз, а анемия может усугубить их прогрессирование. В этом ретроспективном исследовании исследовали распространенность и прогностическое значение анемии у 114 собак с дегенеративным заболеванием митрального клапана (DMVD). Были проанализированы клинические параметры предварительной обработки, распространенность анемии и азотемии и времени выживания в связи с тяжестью ХСН. Распространенность анемии была самой высокой у собак с IV классом ХСН по модифицированной классификации (NYHA) (33,3%), за которой следуют III ФК (15,2%) и II ФК (0%, р<0,001). Присутствие анемии ассоциировалось с тяжестью ХСН и сывороточным креатинином более 1,6 мг/дл (р<0,001). У анемичных собак было более короткое среднее выживание [13 месяцев; 95% доверительный интервал (ДИ): 0,7-19,1], чем у неанемичных (28 месяцев, 95% ДИ: 15,3-40,7, р<0,001). Наличие IV ФК класса ХСН по NYHA (отношение риска (HR): 3,1, 95% ДИ: 2,2-4,3, р <0,001), соотношение левого предсердия к аорте выше 1,7 (HR: 2,7, 95% ДИ 1,7-4,2, р = 0,001) и наличие анемии (HR: 1,43, 95% ДИ: 1,1-1,9, р = 0,004) выступали в качестве предикторов смертности. Нами наблюдался синдром, подобный синдрому кардиоренальной анемии и анемия была прогностическим фактором для выживания у собак с дегенеративным заболеванием митрального клапана (ДМВД).
1. Введение
Растет осознание связи между хронической сердечной недостаточностью (ХСН) и почечной недостаточностью (ХПН) у собак [1, 2]. Распространенность азотемии повышается у собак с хроническим заболеванием сердечных клапанов, а риск азотемии увеличивается с высокой степенью синдрома ХСН [1]. У людей дисфункция почек является критическим независимым фактором риска плохого исхода и смертности у пациентов с сердечной недостаточностью (ХСН) [3, 4].
Коморбидность сердечной недостаточности (ХСН), почечная недостаточность (ХПН) и анемия образуют клинический треугольник, называемый сердечно-сосудистым анемическим синдромом, где ХСН и ХПН оказывают отрицательные ответные эффекты, а их обострение обостряется при анемии [5]. Было обнаружено, что анемия является общей сопутствующей патологией у пациентов с ХСН и ее присутствие не только связано с худшими долгосрочными результатами лечения ХСН [6, 7], но также является маркером субклинической коморбидности ХСПН [8]. Анемия и ХПН оказывают аддитивное влияние на смертность и являются независимыми факторами риска смертности у пациентов с ХСН [9, 10].
Анемия, как правило, считается распространенной у пациентов с ХСН, хотя распространенность в литературе варьируется в широких пределах: от 9,9% до более 50% [11, 12]. Тяжесть анемии, как правило, возрастает параллельно с серьезностью функционального класса Нью-Йоркской ассоциации сердца (NYHA) [12, 13]. Патофизиология, связанная с анемией при ХСН у людей, является многофакторной, включая почечную дисфункцию и нарушение продукции эритропоэтина [5], перепроизводство провоспалительных цитокинов, таких как фактор некроза опухолей и интерлейкинов [14, 15], расширение объема плазмы [16] и снижение регуляции эритропоэтина, например, ингибиторами ангиотензинпревращающего фермента [17].
Хотя кардиоренальный анемический синдром менее изучен у собак, чем у людей, картина взаимодействия, подобная той, которая наблюдается у людьми, кажется, работает и в ветеринарии. Nicolle и соавторы обнаружили, что 50% группы из 124 собак с хроническим заболеванием сердечного клапана имели сопутствующую азотемию и что тяжесть азотемии и степень ХПН увеличивалась с выраженностью ХСН [1]. Между тем Slupe и соавторы обнаружили, что 28% группы из 116 собак с ХПН представлены с анемией, характеризующейся низкими концентрациями гематокрита и гемоглобина (Hb) [18].
Связь между ХСН, нарушением функции почек и анемией не была хорошо изучена у собак. Хотя лечение собак с ХСН значительно улучшилось в последние десятилетия, неясно, как азотемия и анемия влияют на выживаемость у собак с ХПН. Целью данного исследования было оценить ассоциации гематологических (концентрация Hb и тромбокрит (PCV)] и биохимических параметров [концентрации мочевины в крови (BUN) и концентрации креатинина] с выживаемостью у собак с хроническим дегенеративным заболеванием митрального клапана (DMVD). Мы предположили, что время выживания сокращается при наличии анемии и азотемии.
2. Материалы и методы
2.1. Животные
Были изучены медицинские записи 1188 собак, которые были обследованы в Отделе кардиологии Национальной ветеринарной клиники Тайваньского университета в период с 2006 по 2015 год. Истории болезни с дегенеративным заболеванием митрального клапана у собак (DMVD) были скомпилированы в соответствии со следующими критериями включения и исключения, которые описаны ниже. Критерием включения был первичный диагноз - дегенеративное заболевание митрального клапана (DMVD), основанный на клинических признаках и результатах физического, торакального рентгенографического и эхокардиографического исследований. Диагностируемые критерии дегенеративного заболевания митрального клапана (DMVD) были основаны на результатах эхокардиографии: 2D-режиме выявление пролапса митрального клапана; любой степени утолщения створок митрального клапана или обоих атриовентрикулярных клапанов; цветная допплеровская идентификация любой степени регургитации митрального клапана [19]. Критерии исключения дегенеративного заболевания митрального клапана (DMVD) были отсутствие клинической картины и кардиального ремоделирования, основанного на результатах эхокардиографии (без увеличения левого предсердия, левого желудочка или обоих желудочков), а соотношение левого предсердия к аорте [LA / Ao] <1,4) [19, 20]. Дегенеративное заболевание митрального клапана (DMVD) с клиническими признаками и LA / Ao более 1,4 при эхокардиографическом обследовании, но не получал никакой терапии ХСН, исключая наличия любых других сердечно-сосудистых заболеваний, болезней, трансмиссивными болезнями, острой / хронической почечной недостаточности или других системных расстройств (желудочно-кишечные, печеночные и неопластические), которые были пролеченны потенциально нефротоксичными препаратами.
Все собаки в этом исследовании получали стандартное лечение в отношении ХСН, включая ингибитор ангиотензинпревращающего фермента, фуросемид, дигоксин и пимобендан на основании клинических признаков и рентгенографической картины грудной клетке и эхокардиографических данных [20].
2.2. Дизайн исследования
2.2.1. Ассоциация переменных с тяжестью ХСН
Случаи исследования были разделены на группы, основанные на системе классификации NYHA и усредненные переменные исследования сравнивались по группам классов NYHA. Следующая клиническая информация по предварительной обработке была собрана из записей о зачисленных признаках: жалобы; клиническое представление; результаты физических обследований, включая системное артериальное давление; результаты анализа крови, такие как концентрация Hb, PCV и концентрации в крови альбумина, мочевины (BUN) и креатинина в крови; и результаты мочи, включая микроскопическое исследование мочевых осадков и удельного веса мочи (рефрактометрический метод). Кроме того, кардиовертебральный индекс был измерен с использованием электронного оборудования в правой боковой проекции цифровых грудных рентгенограмм [21], а отношение левого предсердия к аорте (LA / Ao, измеренное в двумерном режиме ЭХО по короткой оси), сравнивались по классам ХСН по NYHA [19].
В этом исследовании анемия была определена как Hb менее 12,5 г/дл и / или PCV менее 35%. Азотемия была определена как мочевина (BUN) более 26 мг/дл и / или креатинин крови выше 1,6 мг/дл.
2.2.2. Выживание
Клиническая прогрессия оценивалась путем обзора медицинских записей. Время выживания подсчитывалось со дня диагностики дегенеративного заболевания митрального клапана (DMVD) до месяца смерти или времени закрытия исследования (31 мая 2015 г.). Когда дата смерти не была доступна по медицинской карте, была осуществлена связь владельца собаки, чтобы получить эту информацию. Конечной точкой исследования была смерть (все причины). Все владельцы собак, чьи истории болезни были включены в это исследование, дали свое информированное согласие. Исследование проводилось в соответствии с кодексом Национального университета Тайваня.
2,3. Анализ данных
Непрерывные данные с нормальными распределениями представлены как средние ± стандартные отклонения, а ненормальные данные представлены как медиана (диапазоны). Однородность дисперсии каждой группы проверяли с помощью теста Левена. Групповые сопоставления результатов анализа крови и мочи проводились с анализом дисперсии и пост-хок анализом Шеффе. Категориальные переменные (т. е. отсутствие или наличие анемии, азотемии) оценивали с помощью критерия Хи-квадрат Пирсона.
Кривые выживаемости Каплана-Мейера были созданы для определения потенциальных прогностических переменных для смерти по любой причине (смертность от всех причин), а также для оценки статистической значимости использовался лог-ранк тест. Собаки, которые были живы во время анализа данных, подвергались цензуре в анализе выживаемости и последняя известная дата живого была использована для собак, потерянных для наблюдения. Был проведен одномерный анализ для оценки предикторов (например, класс IV ХСН по NYHA, LA / Ao более 1.7, наличие анемии, наличие азотемии и креатинина крови выше 1,6 мг / дл) смертности от всех причин. Риски были количественно определены как коэффициенты риска (HR) с 95% доверительными интервалами (КИ). Статистический анализ проводился с использованием коммерческого статистического программного пакета. Значения двух значений считались достоверными при р<0,05.
3. Результаты
3.1. Когортные характеристики
В общей сложности 114 собак (61 самка) соответствовали критериям включения и были вовлечены в исследование. Их средний возраст во время диагностики дегенеративного заболевания митрального клапана (DMVD) составлял 11,1 ± 3,2 года. Шестнадцать пород были представлены в когорте, причем наиболее распространенная порода была мальтийской болонкой. Тридцать восемь собак были классифицированы как класс II ХСН по NYHA, а 46 и 30 собак были классифицированы как классы III и IV по NYHA, соответственно (таблица 1).
Таблица 1 - Исходные характеристики 114 собак, страдающих дегенеративным митральным клапанным заболеванием с ХСН согласно модифицированной функциональной классификации Нью-Йоркской ассоциации сердца (NYHA).
| Параметр | NYHA II (n = 38) | NYHA III (n = 46) | NYHA IV (n = 30) |
| Hb, g/dL | 16.9 ± 2.0 | 14.5 ± 2.8† | 13.8 ± 2.9† |
| Гематокрит, % | 47.1 ± 5.5 | 39.6 ± 8.1† | 37.8 ± 7.9† |
| Эритроциты, Т/л | 7.2 ± 1.0 | 6.1 ± 1.2† | 5.9 ± 1.4† |
| Наличие анемии | 0% (0/38) | 15.2% (7/46) | 33.3%† (10/30) |
| Альбумин, g/dL | 3.3 ± 0.5 | 3.1 ± 0.5 | 3.1 ± 0.4† |
| Мочевина, mg/dL | 26.5 ± 15.8 | 37.3 ± 14.9 | 50.8 ± 17.8† |
| Креатинин, mg/dL | 0.9 ± 0.4 | 1.1 ± 0.6 | 1.4 ± 1.0† |
| Наличие азотемии | 34.2% (13/38) | 41.3% (19/46) | 63.3% (19/30) |
| Наличие креатинина выше 1.6 mg/dL | 5.3% (2/38) | 17.4% (8/46) | 23.3%† (7/30) |
| Удельный вес мочи | 1.028 ± 0.011 | 1.025 ± 0.012 | 1.023 ± 0.009 |
Данные представлены как среднее ± стандартное отклонение или % (n).
BUN, азот мочевины крови; CRE, креатинин крови; Hb, гемоглобин; Эр, эритроциты.
† p <0,05 по сравнению со II классом.
3.2. Распространенность анемии и азотемии
Концентрация гемоглобина, гематокрита и количества эритроцитов были самыми высокими при II классе ХСН по NYHA (16,9 ± 2,0 г/дл, 47,1 ± 5,5% и 7,2 ± 1,0 Т/л соответственно), а затем при III ФК (14,5 ± 2,8 г/дл 13,6 ± 2,9 г/дл, 37,8 ± 7,9% и 5,9 ± 1,4 Т/л, соответственно, р<0,001, р<0,001 и p <0,001, соответственно, таблица 2). Общая распространенность анемии у собак с дегенеративной болезнью митрального клапана (эндокардиоз) составила 14,9%, причем распространенность проявляла тенденцию к повышению ФК с II (0%) до III класса (15,2%) до IV класса (33,3%, р <0,001, таблица 2). Наличие анемии было положительно связано с тяжестью функциональной классификации ХСН по NYHA и креатинина крови выше 1,6 мг/дл (как p<0,001), но не с наличием азотемии (p=0,074).
Таблица 2 - Результаты клинических испытаний у 114 собак с дегенеративным митральным клапанным заболеванием с ХСН в соответствии с модифицированной функциональной классификацией Нью-Йоркской ассоциации сердца (NYHA).
| Параметр | NYHA II (n = 38) | NYHA III (n = 46) | NYHA IV (n = 30) |
| Hb, g/dL | 16.9 ± 2.0 | 14.5 ± 2.8† | 13.8 ± 2.9† |
| Гематокрит, % | 47.1 ± 5.5 | 39.6 ± 8.1† | 37.8 ± 7.9† |
| Эритроциты, Т/л | 7.2 ± 1.0 | 6.1 ± 1.2† | 5.9 ± 1.4† |
| Наличие анемии | 0% (0/38) | 15.2% (7/46) | 33.3%† (10/30) |
| Альбумин, g/dL | 3.3 ± 0.5 | 3.1 ± 0.5 | 3.1 ± 0.4† |
| Мочевина, mg/dL | 26.5 ± 15.8 | 37.3 ± 14.9 | 50.8 ± 17.8† |
| Креатинин, mg/dL | 0.9 ± 0.4 | 1.1 ± 0.6 | 1.4 ± 1.0† |
| Наличие азотемии | 34.2% (13/38) | 41.3% (19/46) | 63.3% (19/30) |
| Наличие креатинина более 1.6 mg/dL | 5.3% (2/38) | 17.4% (8/46) | 23.3%† (7/30) |
| Удельный вес мочи | 1.028 ± 0.011 | 1.025 ± 0.012 | 1.023 ± 0.009 |
Данные представлены как среднее ± SD или % (n).
BUN, азот мочевины крови; CRE, креатинин крови; Hb, гемоглобин; Эр, эритроциты.
† p<0,05 по сравнению со II классом.
Концентрации мочевины и креатинина в крови были самыми высокими при ХСН IV класса (50,8 ± 17,8 и 1,4 ± 0,9 мг/дл), а затем III ФК (37,3 ± 14,9 и 1,1 ± 0,6 мг/дл) и II (26,5 ± 15,8 и 0,9 ± 0,4 мг/dL; p=0,032 и p=0,018, соответственно, таблица 2). Общая распространенность азотемии у собак с дегенеративной клапанной болезнью составила 44,7%, самая высокая при IV классе ХСН по NYHA (63,3%), а затем III ФК (41,3%) и II ФК (34,2%), но различия между тремя классами были незначительными (p=0,104, таблица 2). Общая распространенность наличия креатинина в крови более уровня 1,6 мг/дл была 14,9%, самая высокая при IV классе ХСН NYHA (23,3%), а затем III ФК (17,4%) и II ФК (5,3%). Распространенность креатинина в крови более 1,6 мг/дл среди трех групп была значительно различной (р=0,035, таблица 2).
3.3. Анализ выживания
Из 114 собак с дегенеративной клапанной болезнью 101 смогли завершить наблюдение и 34 были еще живы в конце исследования и данные об этих собаках подвергались цензурированию из анализа выживаемости. Медиана времени выживания составляло 24 месяца (95% ДИ: 18,5-29,5). Среднее время выживания для II, III и IV классов составляло 42 месяца (95% ДИ: 33,7-50,3), 26 месяцев (95% ДИ: 21,3-30,7) и 7 месяцев (95% ДИ: 3,6-10,4) соответственно (p<0,001, таблица 1). Медиана времени выживания для собак без анемии составляла 28 месяцев (95% ДИ: 15,3-40,7), а для тех, у которых была анемия, было 13 месяцев (95% ДИ: 0,7-19,1, p<0,001; Рисунок 1. Медиана времени выживания у собак без азотемии составляло 39 месяцев (95% ДИ: 20,4-57,5), а у пациентов с азотемией было 20 месяцев (95% ДИ: 14,5-25,5, p=0,173). Медиана времени выживания для собак с креатинином крови менее и равном 1,6 мг/дл составило 43 месяца (95% ДИ: 18,2-67,5), а для пациентов с содержанием креатинина в крови выше 1,6 мг/дл составило 20 месяцев (95% ДИ: 10,5-29,5; = 0,159).
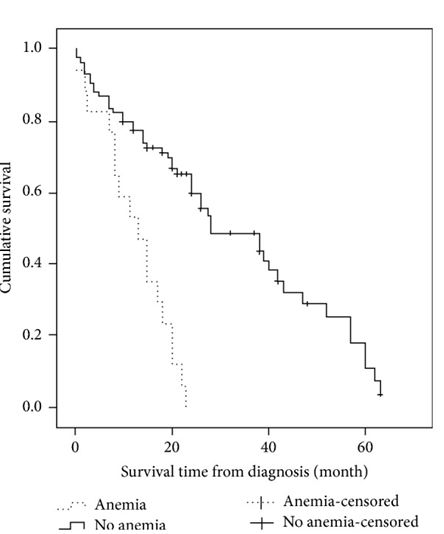
Рис. 1 Кривые Каплана-Мейера демонстрируют выживаемость 101 собаки с недавно диагностированной дегенеративным заболеванием митрального клапана и классифицированным по статусу анемии при предварительной обработке (концентрация гемоглобина менее 12,5 г/дл и / или гематокрита менее 35%).
Данные для собак, которые все еще оставались живы (n=34) в конце исследования, подвергались цензурированию (штриховка).
Одномерный анализ показал, что обозначение группы IV класса ХСН по NYHA (HR: 3,1, 95% ДИ: 2,2-4,3, p<0,001), LA/Ao более 1,7 (HR: 2,7, 95% ДИ 1,7-4,2, p=0,001), а наличие анемии (HR: 1,43, 95% ДИ: 1,1-1,9, р=0,004) были значимыми предикторами смертности от всех причин. Между тем, наличие азотемии и креатинина в крови выше 1,6 мг/дл не было предикторами смертности от всех причин при однофакторном анализе.
4. Обсуждение
В этом исследовании мы обнаружили, что концентрация гемоглобина и гематокрит снижались с увеличением тяжести функционального статуса ХСН по NYHA у собак с дегенеративным заболеванием митрального клапана. Между тем, уровни мочевины, креатинина в крови, распространенность анемии и распространенность креатинина в крови выше 1,6 мг/дл увеличились с увеличением тяжести ХСН. Анемия была связана с плохим исходом и была предсказателем смертности.
Настоящие результаты согласуются с данными, полученными у людей, свидетельствующими о том, что распространенность коморбидности анемии при ХСН увеличивается с увеличением тяжести ее функционального статуса по NYHA и что анемия является прогностическим фактором смертности [12, 13]. Общая распространенность анемии в этом исследовании (14,5%) была ниже, чем сообщалось ранее (28%) [18]; однако увеличение распространенности анемии было связано с большей тяжестью синдрома ХСН, причем в группе IV класса ХСН по NYHA анемический синдром достигал 33,3%.
Хотя точная патофизиология анемии у собак с дегенеративным заболеванием митрального клапана еще не известна, стоит отметить, что собаки с расстройствами, которые могут потенциально вызывать анемию, не зависящую от ХСН, такие как клещевые заболевания, хроническая почечная недостаточность и неоплазия [22], были исключены из этого исследования. Аналогичным образом, также были исключены собаки с системными заболеваниями, которые могут вызвать дефицит железа, такие как хроническая энтеропатия.
Наши данные о более высоких уровнях мочевины, креатинина в крови и распространенность повышения креатинина в крови выше 1,6 мг/дл среди собак с прогрессирующей ХСН согласуются с предыдущими исследованиями [1, 23]. Ни одна из собак в этом исследовании не страдала острыми или хроническими почечными расстройствами и ни один из них не имел низкий удельной массой мочи. Таким образом, наличие азотемии, по-видимому, было вторичным по отношению к ХСН [1], хотя сравнение распространенности наличия азотемии в различных группах классов NYHA не достигало значимости.
Насколько нам известно, это первое исследование, демонстрирующее эффект анемии на выживаемость у собак с ХСН в ветеринарной литературе [18]. Мы обнаружили, что прогноз был менее благоприятным при анемии, чем для неанемичных собак и что концентрация гемоглобина после предварительного лечения менее 12,5 г/дл была предиктором плохого результата. Эти результаты согласуются с исследованиями ХСН у людей, указывая на то, что анемия является независимым предиктором смертности у пациентов с ХСН [7, 13, 24]. Коррекция анемии настоятельно рекомендуется для улучшения результатов лечения у пациентов с ХСН [24]. Необходимы исследования эффективности коррекции анемии для улучшения результатов у собак с дегенеративным заболеванием митрального клапана.
Настоящие данные, свидетельствующие о том, что тяжесть ХСН при первичном приеме и LA/Ao более 1,7 также были предикторами плохого исхода у собак с дегенеративным заболеванием митрального клапана, согласуются с результатами предыдущих исследований [25, 26]. Хотя результаты анализа крови в крови креатинина выше 1,6 мг/дл были более распространены в тяжелых случаях ХСН, по сравнению с менее тяжелыми случаями, он не был значительно связан с плохим результатом и не был предсказателем смертности.
В этом исследовании наличие анемии было положительно связано как с тяжесть ХСН, так и с креатинином крови выше 1,6 мг/дл, признаком развития почечной недостаточности. Сывороточный креатинин выше 1,6 мг/дл также был более распространен у собак с развитой ХСН. Соотношения между ХСН, ХПН и анемией, наблюдаемые в этой когорте, согласуются с так называемым «синдромом кардиоренальной анемии», описанным у людей [5] и подтверждают мнение о наличии причинно-следственных связей между синдромами сердечной недостаточности почечной недостаточности и анемии у собак с дегенеративным заболеванием митрального клапана.
Это исследование имеет некоторые ограничения, которые стоит отметить. У нас не было контрольного сравнения распространенности анемии и азотемии и у нас не было сопоставимой по возрасту здоровой контрольной группы, с помощью которой можно было сравнить продолжительность жизни.
5. Выводы
Предварительная терапия анемии, показанной при гемоглобине 12,5 г/дл, во время диагностики дегенеративного заболевания митрального клапана является предиктором плохого исхода у собак. Анемия также стала прогностическим фактором выживания у собак с дегенеративным заболеванием митрального клапана. У собак с дегенеративным заболеванием митрального клапана наблюдаются синдромы, связанные с синдромом кардиоренальной анемии, с соответствующими клиническими признаками.
Конкурирующие интересы
Авторы заявляют, что у них нет конкурирующих интересов.
Литература
- Nicolle A. P., Chetboul V., Allerheiligen T., et al. Azotemia and glomerular filtration rate in dogs with chronic valvular disease. Journal of Veterinary Internal Medicine. 2007;21(5):943–949. doi: 10.1892/0891-6640(2007)21[943:AAGFRI]2.0.CO;2.
- Pouchelon J. L., Atkins C. E., Bussadori C., et al. Cardiovascular-renal axis disorders in the domestic dog and cat: a veterinary consensus statement. Journal of Small Animal Practice. 2015;56(9):537–552. doi: 10.1111/jsap.12387.
- Hillege H. L., Girbes A. R. J., de Kam P. J., et al. Renal function, neurohormonal activation, and survival in patients with chronic heart failure. Circulation. 2000;102(2):203–210. doi: 10.1161/01.cir.102.2.203.
- Forman D. E., Butler J., Wang Y., et al. Incidence, predictors at admission, and impact of worsening renal function among patients hospitalized with heart failure. Journal of the American College of Cardiology. 2004;43(1):61–67. doi: 10.1016/j.jacc.2003.07.031.
- Silverberg D. S., Wexler D., Blum M., Iaina A. The cardio renal anemia syndrome: correcting anemia in patients with resistant congestive heart failure can improve both cardiac and renal function and reduce hospitalizations. Clinical Nephrology. 2003;60(supplement 1):S93–S102.
- Ezekowitz J. A., McAlister F. A., Armstrong P. W. Anemia is common in heart failure and is associated with poor outcomes: insights from a cohort of 12 065 patients with new-onset heart failure. Circulation. 2003;107(2):223–225. doi: 10.1161/01.cir.0000052622.51963.fc.
- Mozaffarian D., Nye R., Levy W. C. Anemia predicts mortality in severe heart failure: the prospective randomized amlodipine survival evaluation (PRAISE) Journal of the American College of Cardiology. 2003;41(11):1933–1939. doi: 10.1016/s0735-1097(03)00425-x.
- Komajda M. Prevalence of anemia in patients with chronic heart failure and their clinical characteristics. Journal of Cardiac Failure. 2004;10(1):S1–S4.
- Al-Ahmad A., Rand W. M., Manjunath G., et al. Reduced kidney function and anemia as risk factors for mortality in patients with left ventricular dysfunction. Journal of the American College of Cardiology. 2001;38(4):955–962.
- McClellan W. M., Flanders W. D., Langston R. D., Jurkovitz C., Presley R. Anemia and renal insufficiency are independent risk factors for death among patients with congestive heart failure admitted to community hospitals: a population-based study. Journal of the American Society of Nephrology. 2002;13(7):1928–1936.
- Cohn J. N., Tognoni G. A randomized trial of the angiotensin-receptor blocker valsartan in chronic heart failure. The New England Journal of Medicine. 2001;345(23):1667–1675. doi: 10.1056/nejmoa010713.
- Silverberg D. S., Wexler D., Blum M., et al. The use of subcutaneous erythropoietin and intravenous iron for the treatment of the anemia of severe, resistant congestive heart failure improves cardiac and renal function and functional cardiac class, and markedly reduces hospitalizations. Journal of the American College of Cardiology. 2000;35(7):1737–1744.
- Horwich T. B., Fonarow G. C., Hamilton M. A., MacLellan W. R., Borenstein J. Anemia is associated with worse symptoms, greater impairment in functional capacity and a significant increase in mortality in patients with advanced heart failure. Journal of the American College of Cardiology. 2002;39(11):1780–1786.
- Levine B., Kalman J., Mayer L., Fillit H. M., Packer M. Elevated circulating levels of tumor necrosis factor in severe chronic heart failure. The New England Journal of Medicine. 1990;323(4):236–241. doi: 10.1056/nejm199007263230405.
- Weiss G., Goodnough L. T. Anemia of chronic disease. The New England Journal of Medicine. 2005;352(10):1011–1023.
- Androne A.-S., Katz S. D., Lund L., et al. Hemodilution is common in patients with advanced heart failure. Circulation. 2003;107(2):226–229.
- Volpe M., Tritto C., Testa U., et al. Blood levels of erythropoietin in congestive heart failure and correlation with clinical, hemodynamic, and hormonal profiles. The American Journal of Cardiology. 1994;74(5):468–473.
- Slupe J. L., Freeman L. M., Rush J. E. Association of body weight and body condition with survival in dogs with heart failure. Journal of Veterinary Internal Medicine. 2008;22(3):561–565.
- Hansson K., Häggström J., Kvart C., Lord P. Left atrial to aortic root indices using two-dimensional and M-mode echocardiography in cavalier King Charles Spaniels with and without left atrial enlargement. Veterinary Radiology and Ultrasound. 2002;43(6):568–575.
- Atkins C., Bonagura J., Ettinger S., et al. Guidelines for the diagnosis and treatment of canine chronic valvular heart disease. Journal of Veterinary Internal Medicine. 2009;23(6):1142–1150.
- Buchanan J. W., Bücheler J. Vertebral scale system to measure canine heart size in radiographs. Journal of the American Veterinary Medical Association. 1995;206(2):194–199.
- Chervier C., Cadoré J. L., Rodriguez-Piñeiro M. I., Deputte B. L., Chabanne L. Causes of anaemia other than acute blood loss and their clinical significance in dogs. Journal of Small Animal Practice. 2012;53(4):223–227.
- Pouchelon J.-L., King J., Martignoni L., et al. Long-term tolerability of benazepril in dogs with congestive heart failure. Journal of Veterinary Cardiology. 2004;6(1):7–13. d
- Groenveld H. F., Januzzi J. L., Damman K., et al. Anemia and mortality in heart failure patients. A systematic review and meta-analysis. Journal of the American College of Cardiology. 2008;52(10):818–827.
- Borgarelli M., Abbott J., Braz-Ruivo L., et al. Prevalence and prognostic importance of pulmonary hypertension in dogs with myxomatous mitral valve disease. Journal of Veterinary Internal Medicine. 2015;29(2):569–574.
- Borgarelli M., Savarino P., Crosara S., et al. Survival characteristics and prognostic variables of dogs with mitral regurgitation attributable to myxomatous valve disease. Journal of Veterinary Internal Medicine. 2008;22(1):120–128.
^Наверх









